包括内部核糖体进入位点的质粒和其用途的制作方法
相关申请案
本申请案主张根据2015年4月30日提交的美国临时申请案第62/154,858号和2014年10月10日提交的美国临时申请案第62/062,245号的35u.s.c.§119(e)的权益,每个申请案的全部内容以全文引用的方式并入本文中。
联邦政府资助的研究
本发明根据美国国立卫生研究院授予的2r01ca068490-19和2r01ca076120-13在政府支持下进行。政府拥有本发明中的某些权利。
背景技术:
报道基因测定已经在制药和生物技术工业中常规地使用以识别影响蛋白功能的前导化合物。在近十年中,化学家在短时间内通过如组合化学反应的技术合成大量化学化合物的能力已大大提高,并且常常需要筛选数千到数百万的化合物以识别对所关注蛋白质具有期望效应的那些化合物。
通常,报道基因测定测量在样品中的一种报道基因蛋白的活性,但是可结合多种报道基因。用于共表达多种报道基因的一个策略涉及双顺反子构建体的设计,其中通过内部核糖体进入位点(ires)序列分隔开的两种基因在常见上游启动子的控制下表达为单个转录盒(或双顺反子转录)(延(yen)等人,《科学(science.)》2008年11月7日;322(5903):918-23)。插入ires序列充当用于有效的帽独立性内部翻译起始的核糖体结合位点。此类设计实现具有ires引导的帽独立性翻译的两种基因两者的转录。此系统允许在实验处理时不期望改变的对照报道基因与在每个测试样品中归一化为所述对照的测试报道基因一起共表达。然而,相比于帽独立性翻译,在细胞中的许多扰动可差异地影响帽依赖性翻译。此外,一些ires已经示出显示下游基因的可变表达(王(wong)等人《基因疗法(genether.)》2002年3月;9(5):337-44)。这导致高的假阳性和不可靠的报道基因测定。因此,存在用于分析蛋白稳定性的有效高通量方法的需要,其中报道基因活性的非特异性变异用于控制在细胞类蛋白稳定性测定中的固有变化。这使得降低有效且高效地运行hts测定所需要的数据的错误。
技术实现要素:
在一些方面,本公开涉及可用于在特异性扰动之后有效地监测数千蛋白的稳定性的质粒的开发。
在一些方面,本公开提供一种dna质粒。所述质粒包括可操作连接启动子;第一内部核糖体进入位点(ires);编码第一报道基因蛋白的核苷酸序列;第二ires;以及编码第二报道基因蛋白的核苷酸序列,其中开放阅读框(orf)融合到编码第一报道基。因蛋白的所述核苷酸序列或融合到编码第二报道基因蛋白的所述核苷酸序列。
在一些实施例中,所述第一和第二报道基因蛋白具有可区分的可检测报道基因信号。在一些实施例中,所述第一和第二报道基因蛋白为具有由其产物产生的可区分信号的酶蛋白。在一些实施例中,所述第一和第二报道基因蛋白为具有可区分生物发光信号的生物发光蛋白。在一些实施例中,所述第一和第二报道基因蛋白为具有可区分荧光信号的荧光蛋白。在一些实施例中,所述第一和第二报道基因蛋白选自由海肾荧光素酶(rluc)和萤火虫荧光素酶(fluc)组成的群组。在一些实施例中,所述第一和第二报道基因蛋白选自由绿色荧光蛋白和红色荧光蛋白组成的群组。在一些实施例中,所述启动子为真核启动子或合成启动子。在一些实施例中,所述启动子包括巨细胞病毒(cmv)启动子。在一些实施例中,所述开放阅读框来源于生物体的orfeome。在一些实施例中,所述开放阅读框编码癌蛋白。在一些实施例中,所述癌蛋白选自由以下组成的群组:myc、ikaros家族锌指蛋白1(ikzf1)、ikaros家族锌指蛋白3(ikzf3)、干扰素调节因子4(irf4)、突变体p53、n-ras、c-fos和c-jun。
本公开的一些方面涉及包括本文所述的质粒的分离转化的宿主细胞。在一些实施例中,所述宿主细胞为细菌细胞、酵母细胞、植物细胞、昆虫细胞或哺乳动物细胞。
根据一些方面,本公开提供一种包括多种质粒的dna质粒文库,其中每种所述质粒包括以可操作连接的启动子;第一内部核糖体进入位点(ires);编码第一报道基因蛋白的核苷酸序列;第二ires;以及编码第二报道基因蛋白的核苷酸序列,其中开放阅读框融合到编码第一报道基因蛋白的所述核苷酸序列或融合到编码第二报道基因蛋白的所述核苷酸序列。
在一些实施例中,每种质粒的所述开放阅读框不同。在一些实施例中,每种质粒的所述开放阅读框来源于生物体的orfeome。在一些实施例中,所述生物体为哺乳动物。在一些实施例中,所述哺乳动物为人类。在一些实施例中,所述第一和第二报道基因蛋白具有可区分的可检测报道基因信号。在一些实施例中,所述第一和第二报道基因蛋白为具有可区分生物发光信号的生物发光蛋白。在一些实施例中,所述第一和第二报道基因蛋白为具有可区分荧光信号的荧光蛋白。在一些实施例中,所述第一和第二报道基因蛋白为选自由海肾荧光素酶(rluc)和萤火虫荧光素酶(fluc)组成的所述群组。在一些实施例中,所述第一和第二报道基因蛋白选自由绿色荧光蛋白和红色荧光蛋白组成的所述群组。在一些实施例中,所述启动子为真核启动子或合成启动子。在一些实施例中,所述启动子包括巨细胞病毒(cmv)启动子。
根据一些方面,本公开提供一种用于识别其水平通过所关注的化合物调节的蛋白的方法,所述方法包括:使用本文所述的质粒文库转化的宿主细胞与所关注的化合物接触;在所述化合物存在和不存在下,测定融合的报道基因蛋白信号与未融合的报道基因蛋白信号的比率;识别当在所述化合物存在下融合的报道基因蛋白信号与未融合的报道基因蛋白信号的比率与在不存在所述化合物下融合的报道基因蛋白信号与未融合的报道基因蛋白信号的比率相比增加时具有增加含量的开放阅读框,以及识别当在所述化合物存在下融合的报道基因蛋白信号与未融合的报道基因蛋白信号的比率与在所述化合物存在下融合的报道基因蛋白信号与未融合的报道基因蛋白信号的比率相比降低时具有降低含量的开放阅读框。
在一些实施例中,使用本文所述的质粒文库的转化的宿主细胞与所关注的测试化合物接触包括在所述化合物存在下使所述转化的宿主细胞生长适当的时间。在一些实施例中,所关注的化合物为
根据一些方面,本公开提供一种用于监测用imid化合物治疗受试者的方法,所述方法包括:测定在用imid化合物治疗的受试者的样本中ikzf1和/或ikzf3的含量;以及当与参考含量相比ikzf1和/或ikzf3的含量降低时将所述受试者识别为对所述治疗的应答。
在一些实施例中,所述参考含量为在尚未用所述imid化合物治疗的对照受试者中ikzf1和/或ikzf3的所述含量。
本发明的实施例和方面中的每个可独立或组合实践。此外,在此所用的措词和术语是出于说明的目的并且不应该被视为是限制性的。本文“包含”、“包括”或“具有”、“含有”、“涉及”以及其变体的使用意指涵盖在其后所列举的项目和其等效物以及额外项目。
参照具体实施方式,本发明的这些和其它方面以及各种优点和效用将变得显而易见。本发明的每个方面可涵盖如将被理解的各种实施例。
在本申请案中识别的所有文献以其全部内容以引入方式并入本文。
附图说明
附图并不打算按比例绘制。在所述附图中,不同的图中所说明的每个相同或几乎相同的组件用类似的数字表示。为了清楚的目的,在每一个附图中可能没有标记每一个组件。在所述附图中:
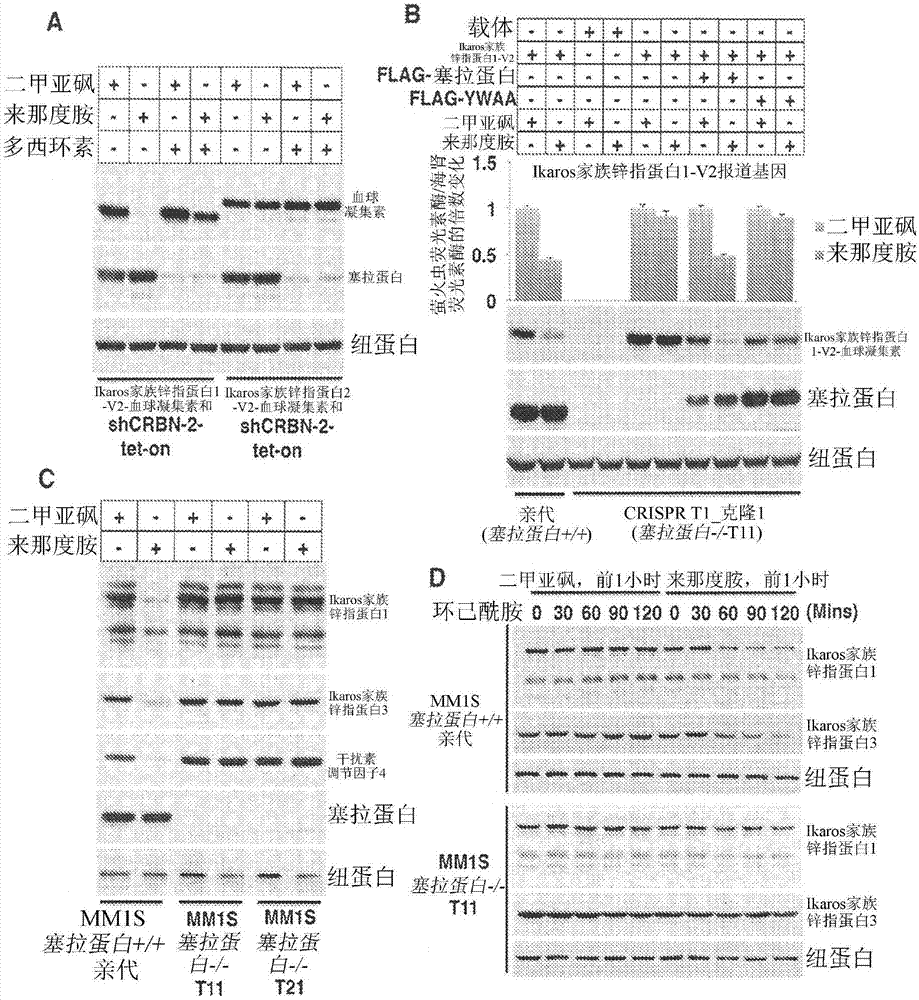
图1a至1e示出通过来那度胺下调ikzf1和ikzf3。(图1a)载体示意图。(图1b)在来那度胺(len)(2μm)处理之后fluc/rluc比率的倍数变化的分布。(图1c和1d)为了产生融合到fluc(上图)或ha标签(下图)的指定ikzf蛋白转染的293ft细胞的fluc/rluc比率(上图)和免疫印迹(下图)。在指定的情况下,细胞用来那度胺(2μm)、mln4924(1μm)或mg132(10μm)处理12小时。将fluc/rluc比率归一化为相对应的二甲亚砜(dmso)处理的细胞。数据以平均值±sd(n=4)形式呈现。(图1e)用如指定的len(2μm)和mln4924(1μm)处理12小时的mm1s和l363细胞的免疫印迹分析。
图2a至2d描绘通过来那度胺的ikzf1和ikzf3的下调需要塞拉蛋白(cereblon)。(图2a)用表达指定的ikzf-ha蛋白和多西环素诱导性crbnshrna的慢病毒载体稳定感染的293ft细胞的免疫印迹分析。在指定的情况下,分别将len(2μm)和多西环素(dox)(μg/ml)添加12小时和60小时。(图2b)为了产生融合到fluc(上图)或ha标签(下图)的ikzf1,转染的crbn+/+和crbn-/-293ft细胞的fluc/rluc比率(上图)和免疫印迹(下图)。其中指定的细胞用len(2μm)处理12小时。将fluc/rluc比率归一化为相对应的dmso处理的细胞。数据以平均值±sd(n=4)形式呈现。(图2c和2d)crbn+/+和crbn-/-mm1s骨髓瘤细胞的免疫印迹分析。在指定的情况下,在将环己酰胺(chx)(100μg/ml)添加一段指定的时间段(图2d)之前,细胞用len(2μm)处理24小时(图2c)或1小时。
图3a至3f示出了来那度胺通过塞拉蛋白促进ikzf1和ikzf3的泛素化。(图3a和3b)flag-ikzf从为了产生指定ikzf蛋白稳定传染的crbn-/-293ft细胞免疫沉淀并且用于从为了产生指定crbn变体(图3b)转染的crbn+/+293ft细胞(图3a)或crbn-/-293ft细胞捕获塞拉蛋白。如所指定,细胞在裂解之前用len(2μm)处理12小时。结合蛋白通过免疫印迹分析检测。(图3c)对用镍琼脂糖从为了产生指定的flag-、his-和v5-标记的蛋白转染的293ft细胞中捕获的蛋白进行免疫印记分析。细胞用mg132(10μm),并且在指定的情况下,用len(2μm)处理12小时。(图3d)转染crbn-/-293ft细胞以产生ikzf1-ha和指定的myc-塞拉蛋白变体并且裂解。将提取物混合,用len(2μm)或dmso处理,并且用针对ha(抗-ha)或抗-myc的抗体免疫沉淀。免疫沉淀物与重组e1、e2和泛素(ub)一起培育并且进行免疫印迹分析。
图4描绘与ikzf1和ikzf3的损耗有关的来那度胺的抗骨髓瘤活性。(图4a和4b)用len(2μm)处理指定时间段的骨髓瘤细胞系的免疫印迹分析(图4a)和增殖(图4b)。在(图4b)中,数据是以shi的平均值±sd(n=4)方式呈现。(图4c)在用编码rfp和指定shrnas的病毒感染的mm1s细胞中随时间推移红色荧光蛋白(rfp)阳性%的改变。将对于每种病毒2%rfp的天数归一化为1,并且相对于用编码rfp和对照(cntl)shrna的病毒感染的细胞表达后续值。(图4d)用表达所述指定shrnas的慢病毒短暂感染72小时的mm1s细胞的免疫印迹分析。(图4e)mm1s细胞用编码gfp和所述指定flag-标记蛋白的慢病毒载体感染。对于每种蛋白示出与dmso相比对于用len(2μm)处理所述指定持续时间的细胞gfp阳性的百分比。(图4f)如在(图4e)中感染的和用dmso或len(2μm)处理24小时的mm1s细胞的免疫印迹分析。
图5a至5b示出萤火虫/海肾荧光素酶比率在报道基因质粒浓度范围内是稳定的。293ft细胞用所述指定量的单独编码萤火虫荧光素酶(fluc)(图5a)或hif1α-fluc融合蛋白质(图5b)的质粒短暂转染。添加空白pbluescript-ks以使总质粒dna到800ng。稍后进行双荧光素酶测定48小时并且计算fluc/rluc。
图6a至6b描绘萤火虫荧光素酶融合蛋白的药理学稳定性。293ft细胞用编码未融合的fluc(pirif)或所述指定orf-萤火虫荧光素酶(fluc)融合体的质粒短暂转染,并且然后用dmog(1μm)、mg132(10μm)或媒剂(dmso)处理24小时。hif1α-dpa为缺少脯胺酰基羟基化位点(33)两者的hif1α变体。对于每种质粒示出fluc/rluc值(图6a)和与dmso处理相比fluc/rluc的倍数变化(图6b)。数据为平均值±sd,n=4。
图7a至7b描绘通过泊马度胺对ikzf1和ikzf3的下调。为了产生融合到萤火虫荧光素酶(上图)或血球凝集素(ha)表位标签(下图)的所述指定ikzf蛋白转染的293ft细胞的萤火虫荧光素酶(fluc)/海肾荧光素酶(rluc)比率(图7a)和免疫印迹(图7b)。其中指定的细胞用泊马度胺(pom)(0.2μm)处理12小时。将fluc/rluc比率归一化为相对应的dmso处理的细胞。数据为平均值±sd,n=4。
图8描绘了来那度胺并未显著地影响ikzf1和ikzf3的mrna含量。实时qpcr分析用如指定的len(2μm)和mln4924(1μm)处理12小时的mm1s和l363细胞。数据为平均值±sd,n=3。
图9示出了监测响应于pvhl的hif2α稳定性的改变。图9a为表达融合到nanoluc的萤火虫荧光素酶和hif2α的双顺反子报道基因的示意图。含有ha表位标签和萤火虫荧光素酶的nanoluc通过包括2c端降解决定子(pest)序列部分去稳定,使得内部对照报道基因(萤火虫)的半衰期将与nluc融合更具有可比性,此nluc融合到本身不稳定的hif2α。对于产生非常低的fluc信号如fluc融合的某些不稳定蛋白(例如hif2α)而言,此方法是必需的。图9b示出了对于含有在(图9a)中描绘的报道基因的克隆786-ovhl-/-肾癌细胞的nanoluc与萤火虫荧光素酶值,所述克隆786-ovhl-/-肾癌细胞随后用编码野生型pvhl、肿瘤衍生的pvhl突变体(y98n)的多西环素(dox)诱导性反转录病毒表达载体或用空白病毒感染。在指定的情况下,细胞用dox处理过夜。图9c示出了图17b中使用的细胞的蛋白质印迹。应注意pvhly98n不是完全惰性的。图9d示出了稳定表达hif2α-nluc/萤火虫荧光素酶并且用环己酰亚胺(10μg/ml)处理的786-o肾癌细胞的活性。在用所述蛋白翻译抑制剂环己酰亚胺处理细胞之后,hif2α-nluc和luc2cp以类似半衰期衰变。否则的话,响应于非特异性抑制剂的转录、翻译或蛋白降解,nluc和fluc的比率可改变。
在图10中,将在ubc启动子控制下用表达ires-er-fluc-ires-rluc报道基因的质粒稳定转染的mda-mb-231细胞以20,000个细胞/孔的浓度涂覆在dmem+10%fbs中的不透光96孔板中。第二天,细胞在37℃10%co2下用在dmem+10%fbs中的指定药物处理6小时。所述萤火虫荧光素酶和海肾信号使用所述dual-glo荧光素酶分析系统(普洛麦格(promega))和96孔板读取器(berthold)定量。对每种药物浓度进行三次重复绘制。误差范围是指sd。注意,与环己酰亚胺(chx)相比,er配体影响fluc而不影响rluc。
具体实施方式
在一些方面,本申请涉及可用于在特异性扰动之后有效监测数千蛋白的稳定性的所述质粒的开发。所述质粒允许两种报导基因蛋白的所述共表达,其中的每种处于ires的控制下。以此方式,两种报道基因一起被转录(即由相同mrna编码)并且两者均使用ires翻译。这将由差异地影响ires依赖性与ires独立性翻译的扰动(例如化合物)引起的所述两种报道基因的比率的伪改变的问题最小化,并且因此将假阳性最小化。本发明的其它方面涉及质粒文库,识别其水平通过所关注的化合物调节的蛋白的筛选方法以及用于监测用imid化合物治疗受试者的方法。
根据本发明的一个方面,提供了一种dna质粒。所述质粒包括以可操作连接的(a)启动子,(b)第一内部核糖体进入位点(ires);(c)编码第一报道基因蛋白的核苷酸序列;(d)第二ires;以及(e)编码第二报道基因蛋白的核苷酸序列,其中开放阅读框融合到编码第一报道基因蛋白的所述核苷酸序列或融合到编码第二报道基因蛋白的所述核苷酸序列。
如本文所用,“可操作连接”是指在两种核酸序列如转录控制元件(例如启动子)和连接的经转录序列之间的功能连接。因此,启动子如果可调节所述基因的转录,那么它与基因处于可操作连接。
如本文所使用,“启动子”通常含有提供用于rna聚合酶的结合位点和用于发生转录的转录因子的特异性dna序列(响应性元件)。在一些实施例中,所述启动子为真核启动子或合成启动子。启动子的实例包含但不限于tata盒、来自猿猴病毒40的sv40晚期启动子、巨细胞病毒(cmv)启动子、泛素c启动子(ubc启动子)和t7启动子。这些和其它启动子序列是在本领域中是众所周知的。在本发明的一个实例中,所述启动子为cmv启动子。在本发明的一个实例中,所述启动子为ubc启动子。
如本文所用,“内部核糖体进入位点”或“ires”为调节在rna分子上的所述核糖体的内部进入并且由此调节在真核系统中的翻译的顺式作用核酸元件。在本发明的所述方法和组合物中,第一与第二ires元件包含于所述质粒中。所述第一和第二ires元件允许独立翻译编码报道基因蛋白的核苷酸序列并且开放阅读框融合到编码来自单个信使rna的另一报道基因蛋白的核苷酸序列。在一些实施例中,所述第一和第二ires相同(即,它们具有相同序列)。在一些实施例中,所述第一和第二ires是不相同的(即,它们不具有相同序列)。
许多ires元件已经在病毒和真核基因组两者中识别。此外,也已开发合成ires元件。例如,ires元件已经发现于多种病毒中,包含以下病毒属的成员:肠病毒属(例如人类脊髓灰质炎病毒1(石井(ishii)等人(1998)《病毒学杂志(jvirol.)》72:2398-405和白(shiroki)等人(1997)《病毒学杂志》77:1-8)、人类b型柯萨奇病毒);鼻病毒(例如人类鼻病毒);肝病毒(a型肝炎病毒);心病毒属(脑心肌炎病毒ecmv(基因库寄存编号ab041927的核苷酸2137-2752和金(kim)等人(1992)《分子细胞生物学(molcellbiology)》72:3636-43)和泰勒脑脊髓炎病毒(etheirler′sencephalomyelitisvirus));口蹄疫病毒属(口蹄疫病毒(基因库寄存编号af308157的核苷酸600-1058;贝尔斯罕(belsham)等人(1990)《欧洲分子生物学学会(embo)》77:1105-10;贝利(poyry)等人(2001)rna7:647-60;以及斯通利(stoneley)等人(2000)《核酸研究(nucleicacidresearch)》25:687-94),a型马鼻炎病毒、马b型鼻炎);瘟病毒属(例如牛病毒腹泻病毒(普尔(poole)等人(1995)《病毒学(virology)》206:150-154)和典型猪瘟病毒(莱茵布兰(rijnbrand)等人(1997)《病毒学杂志》77:451-7);丙型肝炎病毒属(例如c型肝炎病毒(冢山-小原(tsukiyama-kohara)等人(1992)《病毒学杂志》66:1476-1483,莱蒙(lemon)等人(1997)《病毒学研讨会(semin.virol.)》5:274-288,和基因库登录号aj242654的核苷酸1201-1812)和gb病毒b)。这些参考文献中的每个均以引用方式并入本文中。
ires元件也已在来自逆转录病毒科的病毒中发现,其包含慢病毒科的成员(例如猿猴免疫缺乏病毒(奥尔曼(ohlmann)等人(2000)《生物化学杂志(journalofbiologicalchemistry)》275:11899-906)和人类免疫缺陷病毒1(巴克(buck)等人(2001)《病毒学杂志》75:181-91);blv-htlv逆转录病毒(例如人类t亲淋巴病毒1型(阿塔尔(attal)等人(1996)《eees快报(eeesletters)》392:220-4);以及哺乳动物c型逆转录病毒家族(例如莫洛尼鼠白血病病毒(moloneymurineleukemiavirus)(瓦格纳(vagner)等人(1995)《生物化学杂志(j.biol.chem)》270:20316-83),弗云德鼠白血病病毒(friendmurineleukemiavirus)、哈维鼠肉瘤病毒(harveymurinesarcomavirus),禽类网状内皮组织增殖病毒(洛佩兹-拉斯特拉(lopez-lastra)等人(1997)《人类基因疗法》5:1855-65),鼠白血病病毒(环境rna)(迪福德(deffaud)等人(2000)《病毒学杂志》74:846-50),劳斯氏肉瘤病毒(roussarcomavirus)(迪福德等人(2000)《病毒学杂志》74:11581-8)。这些参考文献中的每个均以引用方式并入本文中
真核mrna还含有ires元件,其包含例如bip(马切亚克(macejak)等人(1991)《自然(nature)》355:91);果蝇的触角控制基因(外显子d和e)(奥(oh)等人(1992)《基因和发展(genesanddevelopment)》6:1643-1653;c-myc;以及细胞凋亡的x链抑制剂(xiap)基因(美国专利第6,171,821号)。
已经产生各种合成ires元件。参见例如格雷戈里(degregorio)等人(1999)《欧洲分子生物学杂志(emboj.)》75:4865-74;欧文斯(owens)等人(2001)《美国国家科学院院刊(pnas)》4:1471-6;以及文卡特桑(venkatesan)等人(2001)《分子和细胞生物学(molecularandcellularbiology)》21:2826-37。对于本领域中已知的另外的ires元件,参见例如rangueil.inserm.fr/iresdatabase。
在具体实施例中,ires序列来源于脑心肌炎病毒(ecmv)。
如本文所用,报道基因蛋白为当表达时例如可经由其荧光或酶活性特异性地检测(即,当表达时具有可检测信号)的任何蛋白。所述质粒包括编码第一报道基因蛋白的核苷酸序列和编码第二报道基因蛋白的核苷酸序列。开放阅读框融合到编码第一报道基因蛋白的所述核苷酸序列或融合到编码第二报道基因蛋白的所述核苷酸序列。在一些实施例中,所述开放阅读框融合到编码第一报道基因蛋白的所述核苷酸序列。在一些实施例中,所述开放阅读框融合到编码第二报道基因蛋白的所述核苷酸序列。这允许人们研究所述连接开放阅读框响应于不同刺激的表达。如本文所用,“融合”旨在意指由orf编码的氨基酸和报道基因蛋白通过肽键接合以产生连续的蛋白序列。因此,融合到开放阅读框的报道基因蛋白充当融合的开放阅读框的稳定性的标记。未融合到所述开放阅读框的其它报道基因蛋白(并且因此不产生具有由所述orf编码的所述氨基酸的连续蛋白序列)充当针对细胞数量和表达变化归一化的内部对照。
通常,所述第一和第二报道基因蛋白具有可区分的可检测报道基因信号。例如,所述第一和第二报道基因蛋白为具有由其产物产生的可区分的信号的酶蛋白。在一些实施例中,所述第一和第二报道基因蛋白为发射不同波长得光和/或利用不同底物的生物发光蛋白。另选地,所述第一和第二报道基因蛋白为在不同波长下发荧光的荧光蛋白。
可使用本领域中已知的许多报道基因蛋白,其包含但不限于生物发光蛋白、荧光报道基因蛋白和酶蛋白,如产生特异性可检测产物的β-半乳糖苷酶、辣根过氧化酶和碱性磷酸酶。所述荧光报道基因蛋白包含例如绿色荧光蛋白(gfp)、青色荧光蛋白(cfp)、红色荧光蛋白(rfp)和黄色荧光蛋白(yfp)以及其改性的形式,例如增强的gfp(egfp)、增强的cfp(ecfp)、增强的rfp(erfp)、mcherry和增强的yep(eyep)。
生物发光蛋白如荧光素酶的实例,包含但不限于海肾荧光素酶(rluc)、萤火虫荧光素酶(fluc)和nanoluc,在本领域中是已知的(参见例如范(fan),f.和伍德(wood),k.《测定和药物发展技术(assayanddrugdevelopmenttechnologies)》v5#1(2007);古普塔(gupta),r.等人《自然方法(naturemethods)》v8#10(2011);
报道基因蛋白的其它非限制性实例在下文示出:
物质特异性荧光素酶特异性、所需辅因子和物理特性。
在一些实施例中,所述第一和第二报道基因蛋白选自由海肾荧光素酶(rluc)、萤火虫荧光素酶(fluc)和nanoluc组成的所述群组。在一些实施例中,所述第一和第二报道基因蛋白选自由绿色荧光蛋白和红色荧光蛋白组成的所述群组。
开放阅读框融合到编码第一报道基因蛋白的所述核苷酸序列或融合到编码第二报道基因蛋白的所述核苷酸序列任一者。所述开放阅读框融合到所述核苷酸序列的5′或3′末端。如本文所用,开放阅读框或orf是指编码氨基酸的连续序列的核苷酸序列。翻译的开放阅读框可为编码蛋白或所关注的多肽的基因的全部或一部分。所述orf可来源于生物体的orfeome。完全orfeome含有编码给定生物体的所有蛋白的核酸。完整的orfeome的代表性分数为至少60%的由所述生物体表达的所有蛋白。在一些实施例中,所述生物体为哺乳动物。在一些实施例中,所述哺乳动物为人类。
在一些实施例中,所述orf为编码所有或部分癌蛋白的致癌基因。致癌基因的实例包含但不限于ras、myc、src、fos、jun、myb、abl、bcl2、hox11、hox11l2、tal1/scl、lmol、lm02、egfr、mycn、mdm2、cdk4、gli1、igf2、egfr、flt3-itd、tp53、pax3、pax7、bcr/abl、her2neu、flt3r、flt3-itd、tan1、b-raf、e2a-pbx1,和npm-alk,以及pax和fkhr基因家族的成员的融合、wnt、myc、erkegfr、fgfr3、cdh5、kit、ret、干扰素调节因子4(irf4)和trk。其它示范性致癌基因为本领域中众所周知的并且若干此些实例描述于例如《人类癌症的基因基础(thegeneticbasisofhumancancer)》(沃格斯坦(vogelstein),b.和凯泽(kinzler),k.w.编,麦格劳希尔集团(mcgraw-hill),纽约(newyork,n.y.),1998)。
在一些实施例中,所述orf为转录因子。此些转录因子的一些实例包含但不限于所述stat家族(stat1、2、3、4、5a、5b和6)、fos/jun、nfκb、hiv-tat和所述e2f家族。在一些实施例中,所关注的所述蛋白为ikaros家族锌指蛋白。在一些实施例中,所关注的所述蛋白为ikzf1、ikzf2、ikzf3、ikzf4或ikzf5。在一些实施例中,所关注的所述蛋白为ikzf1或ikzf3。
编码报道基因蛋白的所述核苷酸序列和所述融合的orf“在框内”,即,包括编码所述报道基因蛋白的所述核苷酸序列的单个多核苷酸的连续三联体密码子,并且所述融合的开放阅读框编码单个连续的氨基酸序列。
本发明的其它方面提供包括本文所述的质粒的分离转化的宿主细胞。所述质粒可使用本领域中已知的任何可用的技术引入到所述宿主细胞中。例如,所述质粒可通过脂质体转染、磷酸钙转染、deae聚葡萄糖介导的转染、电穿孔、转导、声致穿孔、感染和光学转染引入到所述宿主细胞中。合适的宿主细胞包含但不限于细菌细胞(例如大肠杆菌、枯草杆菌和鼠伤寒沙门氏菌)、酵母细胞(例如酿酒酵母和粟酒裂殖酵母)、植物细胞(例如烟草和陆地棉),和哺乳动物细胞(例如cho细胞,和3t3成纤维细胞、hek293细胞、u-2os细胞)。
本发明的另一个方面提供一种包括本文所述的多种质粒的dna质粒文库(即,多于一种质粒的集合)。在一些实施例中,在所述文库中每种质粒的所述开放阅读框不同。在一些实施例中,在所述文库中每种质粒的所述开放阅读框来源于生物体的orfeome。在一些实施例中,所述生物体为哺乳动物。在一些实施例中,所述哺乳动物为人类。
本发明的另一个方面提供一种用于识别其含量通过所关注的化合物调节的蛋白的方法。所述方法包括:(i)使用本文所述的质粒文库转化的宿主细胞与所关注的化合物接触;(ii)在所述化合物的存在和不存在下确定融合的报道基因蛋白信号与未融合的报道基因蛋白信号的比率;(iii)识别当在所述化合物存在下融合的报道基因蛋白信号与未融合的报道基因蛋白信号的所述比率与在不存在所述化合物下融合的报道基因蛋白信号与未融合的报道基因蛋白信号的所述比率相比增加时具有增加含量的开放阅读框,以及识别当在所述化合物存在下融合的报道基因蛋白信号与未融合的报道基因蛋白信号的所述比率与不存在所述化合物下融合的报道基因蛋白信号与未融合的报道基因蛋白信号的所述比率相比降低时具有降低含量的开放阅读框。
所述宿主细胞可使用本领域中已知的任何可用的技术用所述质粒文库的所述质粒转化。例如,所述质粒可通过脂质体转染、磷酸钙转染、deae聚葡萄糖介导的转染、电穿孔、转导、声致穿孔、光学转染或注射引入到所述宿主细胞中。
如本文所用,“融合的报道基因蛋白信号”是指由融合到所述orf的所述核苷酸序列编码的所述报道基因蛋白的所述可检测信号。如本文所用,“未融合的报道基因蛋白信号”是指由未融合到所述orf的所述核苷酸序列编码的所述报道基因蛋白的所述可检测信号。在一些实施例中,所述开放阅读框融合到编码第一报道基因蛋白的所述核苷酸序列。在此些实施例中,在存在和不存在所述化合物下确定第一报道基因蛋白信号与第二报道基因蛋白信号的比率。识别当在所述化合物存在下第一报道基因蛋白信号与第二报道基因蛋白信号的所述比率与在不存在所述化合物下第一报道基因蛋白信号与第二报道基因蛋白信号的所述比率相比增加时具有增加含量的开放阅读框,以及识别当在所述化合物存在下第一报道基因蛋白信号与第二报道基因蛋白信号的所述比率与在不存在所述化合物下第一报道基因蛋白信号与第二报道基因蛋白信号的所述比率相比降低时具有降低含量的开放阅读框。
在一些实施例中,所述开放阅读框融合到编码第二报道基因蛋白的所述核苷酸序列。在此些实施例中,在存在和不存在所述化合物下确定第二报道基因蛋白信号与第一报道基因蛋白信号的比率。识别当在所述化合物存在下第二报道基因蛋白信号与第一报道基因蛋白信号的所述比率与在不存在所述化合物下第二报道基因蛋白信号与第一报道基因蛋白信号的所述比率相比增加时具有增加的含量的开放阅读框,并且识别当在所述化合物存在下第二报道基因蛋白信号与第一报道基因蛋白信号的所述比率与在不存在所述化合物下第二报道基因蛋白信号与第一报道基因蛋白信号的所述比率相比降低时具有降低的含量的开放阅读框。
所关注的化合物可为已知具有或怀疑具有期望的疾病修饰活性(例如抗肿瘤活性、抗凋亡活性,和抗炎症活性)的任何化合物。其中,这些包含小型有机分子、大环化合物、核苷酸(包含sirnas、shrnas)、核酸(包含能够诱导基因编辑的载体(crispr))、肽、蛋白和碳水化合物。通过识别其含量通过所关注的化合物调节的蛋白,本文所述的方法允许人们评估和理解化合物的药理学活性的潜在机理。此外,本文所述的方法允许发现可用于监测和/或成像所述化合物的药效动力学效应的蛋白。
在一些实施例中,所关注的化合物为
在一些实施例中,使用本文所述的质粒文库转化的所述宿主细胞与所关注的化合物接触包括使所述转化的宿主细胞在所述化合物存在下在合适的培养条件下生长适当时间。合适的培养条件(包含所述培养的持续时间)将根据所培养的所述细胞而变化。然而,本领域技术人员可容易地通过以下标准协议确定所述培养条件,如描述于在《微生物学(microbiology)》学术出版社公司(academicpressinc.)中的系列方法的那些。通常,所述细胞培养基可含有以适当量和组合的以下营养物中的任一种:(一或多种)盐、(一或多种)缓冲液、氨基酸、葡萄糖或其它(一或多种)糖、抗生素、血清或血清替代物,和其它组分如但不限于肽生长因子、辅因子和微量元素。在一些实施例中,所述经转染的宿主细胞在所述化合物存在下生长15分钟、30分钟、1小时、2小时、4小时、6小时、8小时、10小时、12小时、14小时、16小时、18小时、20小时、24小时、30小时、48小时或72小时。
在所述测试化合物的存在和不存在所述测试化合物下使用本领域中已知的方法确定所述融合的和未融合的报道基因蛋白信号。可使用检测器如但不限于光度计、分光光度计和荧光计,或可检测报道基因蛋白活性的改变的任何其它装置。可使用本领域中已知的使得来自单个样品中的两种报道基因的稳定报道基因信号定量的测定系统。实例包含但不限于依次测量来自单个样品的萤火虫和海肾荧光素酶的活性的
在检测由所述报导基因蛋白生成的信号时,确定所关注的所述化合物是否增加或降低融合到所述报道基因蛋白的所述orf的表达。可通过将在所述化合物存在下所述融合的报道基因蛋白信号与未融合的报道基因蛋白信号的所述比率与在不存在所述化合物下所述融合的报道基因蛋白信号与未融合的报道基因蛋白信号的所述比率比较来进行此类确定。与在不存在所述测试化合物下融合的报道基因蛋白信号与未融合的报道基因蛋白信号的所述比率相比,当在所述化合物存在下融合的报道基因蛋白信号与未融合的报道基因蛋白信号的所述比率增加时,将所述orf识别为在所关注的所述化合物存在下具有增加的含量(即,稳定性较高)。相比之下,与在不存在所述测试化合物下融合的报道基因蛋白信号与未融合的报道基因蛋白信号的所述比率相比,当在所述化合物存在下融合的报道基因蛋白信号与未融合的报道基因蛋白信号的所述比率降低时,将所述orf识别为在所关注的所述化合物存在下具有降低的含量(即,稳定性较低)。.
本发明的另一个方面涉及一种用于监测用imid化合物治疗的受试者的方法。所述方法包括在用imid化合物治疗的受试者的样品中确定ikzf1和/或ikzf3的含量;以及当与参考含量相比ikzf1和/或ikzf3的所述含量降低时,将所述受试者识别为对所述治疗作出应答。
如本文所用,术语“受试者”是指患有用imid化合物治疗的病症或失调症的哺乳动物。可用imid治疗的病症或失调症的实例包含但不限于癌症,如多发性骨髓瘤和骨髓纤维化、输血依赖性贫血和骨髓发育不良病症。在一些实施例中,所述受试者为人类。在一些实施例中,所述受试者为非人类哺乳动物。在一些实施例中,所述受试者是非人类灵长类。在一些实施例中,所述受试者为绵羊、山羊、牛、猫或狗。imid的实例包含但不限于来那度胺和cc-4047(泊马度胺)。“监测用imid化合物治疗受试者”是指确定用imid化合物治疗的病症或失调症的进展或缓解。在一些实施例中,“监测用imid化合物治疗受试者”是指确定所述imid化合物是否具有其预测和期望的药物效果。
如本文所用,“从受试者获得的样品”是指从受试者分离的组织或体液的样本,其包含但不限于例如血液、血浆、血清、粪便物、尿、骨髓、胆液、脊髓液、淋巴液、皮肤样本、皮肤、呼吸道、肠道和泌尿生殖道的外部分泌物、眼泪、唾液、奶、血细胞、器官和活体组织切片。在一些实施例中,所述样本为血液、血浆或肿瘤组织。
获得受试者的样本意指拥有所述受试者的样本。从受试者获得样本意指从所述受试者身上取出样本。因此,获得受试者的样本并且确定在所述样品中的ikzf1和/或ikzf3的含量的人不必从所述受试者获得所述生物样本。在一些实施例中,所述样本可通过医疗人员(例如医生、护士,或临床实验室从业者)从所述受试者身上取出,并且然后提供到测定ikzf1和/或ikzf3的含量的所述人。所述样本可通过所述受试者或通过医疗人员(例如医生、护士,或临床实验室从业者)提供到测定ikzf1和/或ikzf3的含量的所述人。在一些实施例中,测定ikzf1和/或ikzf3的含量的所述人通过从所述受试者身上取出的所述样本获得来自所述受试者的生物样本。
应理解样品可以任何适当方式处理以有助于测量ikzf1和/或ikzf3的含量。例如,生物化学、机械和/或热处理方法可适当地用于从生物样本中分离所关注的生物分子。ikzf1和/或ikzf3的所述含量还可在样品中直接测定。
ikzf1(ikaros家族锌指1(ikaros);基因id:10320)编码属于与染色质重构相关的锌指dna结合蛋白的所述家族的转录因子。它在造血系统中起关键作用,并且其功能缺失已与淋巴白血病的发展有关。具体来说,近年来已发现ikaros成为与人类b细胞淋巴母细胞白血病有关的主要肿瘤抑制剂。
ikzf3(ikaros家族锌指蛋白3;基因id:22806)为在b淋巴细胞增殖和分化的调节中重要的转录因子。它与在t细胞中以il2依赖性方式调节bcl2表达和控制细胞凋亡有关。
如本文所用,“测定ikzf1和/或ikzf3的含量”是指测定在所述样本中的ikzf1和/或ikzf3的量或浓度。“测定”是指进行测定以测量ikzf1和/或ikzf3的所述含量。在一些实施例中,“测定”包含例如测定在所述样本中的ikzf1和/或ikzf3的所述表达水平或活性水平。在一些实施例中,测定所述ikzf1和/或ikzf3蛋白的所述表达水平。
ikzf1和/或ikzf3的所述含量可通过进行测定测量。“进行测定”意指测试样本以定量ikzf1和/或ikzf3的含量。使用的测定的实例包含但不限于质谱、气相色谱(gc-ms)、hplc液相层析(lc-ms)和免疫分析。在一些实施例中,ikzf1和/或ikzf3的所述含量通过测量融合到ikzf1或ikzf3的报道基因蛋白的所述含量来测定(参见张(zhang)等人《自然·医学(naturemedicine)》10,643-648(2004)和萨夫兰(safran)等人《美国国家科学院院刊(procnatlacadsciusa.)》2006年1月3日;103(1):105-10)。用于测定ikzf1和/或ikzf3的含量的其它适当方法对于本领域技术人员将是显而易见的。
当与参考含量相比ikzf1和/或ikzf3的所述含量降低时,将所述受试者识别为对所述治疗作出应答。所述参考含量为在尚未用所述imid化合物治疗的对照受试者中的ikzf1和/或ikzf3的所述含量。
根据一些方面,本公开提供一种表征所关注蛋白的功能的方法。所述方法包括提供一种具有融合到ikz1或ikz3或其片段的所关注蛋白的细胞;使所述细胞与imid化合物接触;以及监测所关注蛋白的下调节效果。在一些实施例中,所述细胞在体内中。
如本文所用,“所关注蛋白”可为可被关注的任何可想象的多肽或蛋白,以便研究或以其它方式表征。在一些实施例中,所关注蛋白为人类多肽或蛋白。在一些实施例中,所关注的所述蛋白为癌蛋白,如但不限于ras、myc、src、fos、jun、myb、abl、bcl2、hox11、hox11l2、tal1/scl、lmol、lm02、egfr、mycn、mdm2、cdk4、gli1、igf2、egfr、flt3-itd、tp53、pax3、pax7、bcr/abl、her2neu、flt3r、flt3-itd、tan1、b-raf、e2a-pbx1,和npm-alk,以及pax和fkhr基因家族的成员的融合、wnt、myc、erkegfr、fgfr3、cdh5、kit、ret和trk。其它示范性致癌基因为本领域中众所周知的并且若干此些实例描述于例如《人类癌症的基因基础(thegeneticbasisofhumancancer)》(沃格斯坦,b.和凯泽,k.w.编,麦格劳希尔集团(mcgraw-hill),纽约(newyork,n.y.),1998)。
在一些实施例中,所关注的所述蛋白为转录因子。此些转录因子的一些实例包含但不限于所述stat家族(stat1、2、3、4、5a、5b和6)、fos/jun、nfκb、hiv-tat和所述e2f家族。在一些实施例中,所关注的所述蛋白为ikaros家族锌指蛋白。
如本文所用,ikzf1或ikzf3的“片段”是指小于所述相对应的全长蛋白的ikzf1或ikzf3的任何部分。所述片段包含在imid存在下足以结合到塞拉蛋白的氨基酸。
在一些实施例中,监测下调所关注蛋白的所述效果是指使用本领域中已知的任何方法监测所述细胞的存活力。
通过以下实例进一步说明本发明,所述实例决不应理解为进一步限制。在整个本申请中引用的所有参考文献(包含文献参考、授予的专利、公开的专利申请以及共同待决专利申请)的全部内容特此以引用的方式明确地并入。
实例
材料和方法
细胞培养
将hek293ft(英杰(invitrogen))细胞维持在补充有10%胎牛血清、100u/ml青霉素和100μg/ml链霉素的dmem培养基中。u937、mm1s、kms34、kms11、l363、rpmi8226和ocimy5细胞在含有10%胎牛血清、100u/ml青霉素和100μg/ml链霉素的rpmi培养基中培养。通过慢病毒感染接着荧光激活细胞分选术或在含有0.5或2μg/ml嘌呤霉素、10μg/ml杀稻瘟菌素,或200μg/ml潮霉素的培养基中生长来形成稳定的细胞系。
荧光素酶orf融合文库构建
目的载体pcmv-ires-海肾荧光素酶-ires-gateway-萤火虫荧光素酶(pirigf)通过重叠pcr来构建。人类orfeome文库v5.1经由lrgateway重组(英杰)穿梭到pirigf中。在25℃下重组过夜之后,通过在42℃下热激1分钟将1μl的反应混合物转化到在96孔板中的10μl的omnimax2t1感受态细胞(英杰)中。将100μl的soc培养基添加到每个孔中并且将转化混合物在37℃下培育1小时。接下来,使用96孔深孔板(凯杰(qiagen))将每种混合物转移到含有100μg/ml氨苄西林的1ml2×yt培养基中。在37℃下震荡过夜之后,通过离心收集转化体并且使用directprep96biorobot试剂盒(凯杰)提取质粒。
384孔dual-glo荧光素酶筛选
为了将所述orf荧光素酶融合文库转染到在384孔板中接种的293ft细胞中,在添加dna/转染混合物之前约10分钟平铺25μl的含有7000个细胞的培养基。使用96-一次性尖端的beckmanfx舱头,根据原始orfeomev5.1图谱(169个文库板)排列的单个dna质粒溶液(5μl)稀释到20μl的opti-mem减血清培养基中。20μl的稀释的质粒随后与20μl的稀释的lipofectamine2000(英杰)混合[1:15,在opti-mem减血清培养基中稀释]。在室温下5分钟之后,将3μl的此dna/lipofectamine溶液添加到对应于单个96孔源溶液的两个相同384孔板的4孔象限(总共8个孔)中。所述细胞随后在标准生长条件下生长26至28小时。8通道多点分配器用于将5μl的来那度胺的13.3μm溶液(最终2μm;赛力克化学(selleckchemicals)s1029号)添加到一个板并且将0.13%dmso添加到另一个板,并且使所述细胞再生长17至20小时。根据制造商的说明书(普洛麦格e2940号)使用dual-glo测定来定量萤火虫和海肾荧光素酶的表达。对于数据分析,首先通过来自每个孔的所述萤火虫cps除以海肾cps(fluc/rluc),将原始的每秒计数(cps)归一化为总转染效率。随后将每个板上的四个重复孔的比率取平均值并且确定标准差。随后通过将来自len板的平均fluc/rluc比率除以dmso对照板来确定每个orf的来那度胺(len)诱导的改变(fluc/rluc的改变)。证实与所有显著的比率改变相关的数据来源于显著高于背景信号的原始数据。从进一步分析除去具有>50%标准差的任何一式四份数据以便快速去除大部分来自低表达质粒的数据和其他易出错数据。大部分排除的数据来自低表达克隆。随后将剩余数据(15,483个orf中的13,372个)拟合成具有1.02±0.18的平均len/dmso比率的对数正态分布,并且产生其比率增加(61)或降低(46)3个标准差的orf的列表,用于跟踪测试。
96孔dual-glo荧光素酶分析
为了验证从384孔高通量筛选获得的orf的fluc/rluc的改变,每种克隆在96孔格式中进一步测试。在转染前一天,将293ft细胞接种到在每孔100μl的dmem培养基中具有20,000个细胞的固体不透光96孔板(bd生物科学公司(bdbiosciences))中。在转染的当天,96孔聚丙烯板(葛莱娜(greiner))用于制备所述转染混合物。首先,将含有240ng的orf荧光素酶融合克隆和480ng的pcdna3的质粒混合物稀释到120μl的opti-mem降低的血清中。接下来14.4μl的lipofectamine2000稀释到120μl的opti-mem降低的血清中。5分钟后,使用多通道滴管将所述质粒溶液与所述稀释lipofectamine2000混合。在30分钟之后,将28μl的dna/lipofectamine混合物添加到用293ft细胞(每个orf8个孔)接种的所述96孔板的每个孔。在转染24小时之后,细胞用一式四份的len(2μm)或dmso处理。在转染36小时之后,根据制造商的说明书使用所述dual-glo测定来定量所述萤火虫和海肾荧光素酶信号。计算每个孔的fluc/rluc的所述比率。为了测定每个orf的fluc/rluc的所述改变,len处理的孔的平均fluc/rluc除以dmso处理的孔的平均fluc/rluc。进行双尾学生t检验以确定统计显著性。p值<0.05被认为是显著的。
质粒
人类ikzf4cdna克隆为从ets克隆hscd00295530(plasmid,df/hccdna资源核心(resourcecore))扩增的pcr,并且然后经由bpgateway重组克隆成pdonr223。在pdonr223进入载体中的人类crbn、人类ikzf1剪接变体2(ikzf1-v2)、人类ikzf2剪接变体2(ikzf2-v2)、人类ikzf5和人类irf4从人类orfeome集合(df/hccdna资源核心)获得。ikzf1剪接变体1(ikzf1-v1)cdna和人类ikzf2剪接变体1(ikzf2-v1)cdna通过重叠pcr来生成并且经由bpgateway重组克隆成pdonr223。将ikzf4、ikzf1-v1和ikzf2-v1经由lrgateway重组克隆成pirigf。ikzf1/2嵌合体(ikzf12h1、ikzf12h2、ikzf12h3、ikzf12h4、ikzf21h5、ikzf21h6、ikzf21h7、ikzf2h8、ikzf121和ikzf212)、ikzf1-v2-q146h、ikzf1-v2-h176p/l177f、ikzf2-v1-h141q、ikzf2-v1-p171h/f172l、ikzf1-v1-q146h、ikzf3-q147h突变经由重叠pcr产生并且经由lrgateway重组克隆成pirigf。ikzf1-v2、ikzf2-v2、ikzf3、ikzf4、ikzf5和irf4经由lrgateway重组克隆成plenti-ubc-gate-3xha-pgk-pur。ikzf1-v2、ikzf121、ikzf1-v2-q146h、ikzf1-v2-h176p/l177f、ikzf2-v1h141q、ikzf2-v1-p171h/f172l、ikzf212、ikzf1-v1、ikzf1-v1-q146h、ikzf3和ikzf3-q147h克隆成plenti-ubc-gate-3xha-pgk-hyg。ikzf1-v2和ikzf2-v2经由lrgateway重组克隆成pcdna3.2-dest(英杰)和plenti-ubc-gate-flag-pgk-hyg。ikzf1-v1、ikzf1-v1-q146h、ikzf3、ikzf3-q147h、ikzf2-v2和irf4经由lr重组克隆成plenti-cag-gate-flag-ires-gfp。crbn-y383a/w385a(ywaa)突变通过重叠pcr来生成并且经由bp重组克隆成pdon223。crbn和ywaa经由lr重组克隆成pcdna3-flag-gate-pgk-hyg、plenti-ubc-flag-gate-pgk-hyg、plenti-ubc-ha-gate-pgk-hyg和plenti-ubc-myc-gate-pgk-hyg。在所述慢病毒表达载体内的cdna通过dna定序证实。
crispr基因组编辑
所述通过将配对杂交后的寡核苷酸对克隆成用bbsi(16)(crbnt1正向5′-caccgtcctgctgatctccttcgc-3′(seqidno:1)、crbnt1反向5′-aaacgcgaaggagatcagcaggac-3′(seqidno:2);crbnt2正向5′-caccgaaacagacatggccggcga-3′(seqidno:3)、crbnt2反向5′-aaactcgccggccatgtctgtttc-3′(seqidno:4))消化的px330来生成所述crbn基因编辑载体。在12孔板中接种的293ft细胞使用lipofectamine2000用1μg的crbnpx330编辑载体短暂转染。在转染三天后,细胞以胰蛋白酶处理、放入新鲜生长培养基中并且经由连续稀释接种到96孔板中以获得单个克隆。两周后,挑出单个克隆并且扩增以通过免疫印迹分析验证crbn的编辑。为了靶向mm1s细胞,所述crbnpx330编辑载体穿梭到含有pgk-pur盒的慢病毒主结构中。随后mm1s细胞用plenti-crbncrisprpgk-pur感染并且用0.5μg/ml嘌呤霉素选择三天。稳定细胞经由限制稀释法涂覆在96孔板中。四周后,扩增单个克隆并且通过免疫印迹分析识别crbn-/-克隆。
免疫印迹法
细胞用冰冷pbs洗涤两次并且收集在缓冲液a中[50mmtris(ph7.4)、150mmnacl、1%tritonx-100、1mmedta、1mmegta、1mmβ-甘油磷酸盐、2.5mm焦磷酸钠、1mmna3vo4、10mmnaf,和1×蛋白酶抑制剂(罗氏(roche)]。全细胞提取物通过sds-聚丙烯酰胺凝胶电泳溶解,转移到硝酸纤维膜上,并且用指定的初级抗体探测。结合抗体用辣根过氧化酶结合的二级抗体(pierce)和增强的化学发光(ecl)蛋白质印迹法检测试剂(pierce)或止动剂蛋白质化学发光辣根过氧化酶底物(密理博(millipore))来检测。
抗体
使用以下抗体:hrp结合抗-flagm2小鼠单克隆抗体(西格玛(sigma))、hrp结合抗-ha小鼠单克隆抗体(赛信通(cellsignaling))、hrp结合抗-myc小鼠单克隆抗体(赛信通)、flagm2小鼠单克隆抗体(西格玛)、crbn兔多克隆抗体(诺伍斯生物制剂公司(novusbiologicals))、ikzf1兔多克隆抗体(赛信通,用于免疫印迹)、ikzf1兔多克隆抗体(贝斯(bethyl),用于染色质免疫沉淀)、ikzf2兔多克隆抗体(贝斯)、ikzf3兔多克隆抗体(imginex)、ha.11小鼠单克隆抗体(科文斯(covance))、纽蛋白(vinculin)小鼠单克隆抗体(西格玛)、ddb1兔多克隆抗体(赛信通)、irf4兔多克隆抗体(赛信通)、cul4a兔多克隆抗体(赛信通)、山羊抗-兔hrp结合抗体(赛默科技(thermoscientific))、山羊抗小鼠hrp结合抗体(赛默科技)。
免疫沉淀
细胞溶解在缓冲液b中[50mmtris(ph7.4)、150mmnacl、0.5%np-40、1mmβ-甘油磷酸盐、2.5mm焦磷酸钠1mmna3vo4、10mmnaf,和1×蛋白酶抑制剂(罗氏)]。溶解物通过离心澄清,并且然后在4℃下与初级抗体混合12小时。在指定的情况下,len(2μm)或dmso用于在细胞溶解之前(前)处理所述细胞,或在细胞溶解之后(后)添加到整个细胞提取物中。免疫复合物用蛋白g琼脂糖珠粒(罗氏)在4℃下捕获1小时,并且然后用缓冲液b洗涤6次。对于抗-flag免疫沉淀,细胞提取物用蛋白g琼脂糖珠粒在4℃下预清洁1小时,并且然后与抗-flagm2琼脂糖珠粒在4℃下一起培育6小时,接着用缓冲液b洗涤六次。结合蛋白通过在sds负载缓冲液中沸腾洗提并且通过免疫印迹分析检测。
postlysis结合测定(混合实验)
293ftcrbn-/-t11(cripsrt1克隆1)细胞用表达flag-标记ikzf1或flag-ikzf2慢病毒载体感染或空白慢病毒载体用dmso或len(2μm)处理12小时。细胞随后用冰冷pbs洗涤两次并且溶解在缓冲液b中。在离心之后收集总的细胞提取物并且在4℃下与抗-flagm2琼脂糖珠粒一起培育过夜。接下来,所述珠粒用缓冲液b洗涤四次。在细胞溶解之前(前),所述ikzf1或ikzf2负载的珠粒随后与由用dmso或len(2μm)处理12小时的293ftcrbn+/+细胞制备的整个细胞溶解物混合。在4℃下结合过夜之后,所述琼脂糖用缓冲液b洗涤六次。结合蛋白随后通过在sds负载缓冲液中沸腾洗提,通过sds-page溶解并且通过免疫印迹分析检测。也使用用len(2μm)或dmso细胞溶解后(后)处理的293ft细胞提取物测定flag-标记ikzf1与内源性塞拉蛋白的结合。
为了测定flag-标记ikzf1到外源性塞拉蛋白的结合,所述ikzf1负载的抗-flagm2琼脂糖珠粒用缓冲液b洗涤四次,并且然后与由293ftcrbn缺失t11细胞(用ha-标记的塞拉蛋白(crbn)或塞拉蛋白突变体(ywaa)短暂转染并且在溶解之前用dmso或len(2μm)处理12小时)制备的整个细胞提取物混合。在4℃下结合过夜之后,所述琼脂糖用缓冲液b洗涤六次。结合蛋白随后通过在sds负载缓冲液中沸腾洗提,通过sds-page溶解并且通过免疫印迹分析检测。
为了测定重组塞拉蛋白与内源性ikzf1和ikzf3的结合,在293ftcrbn-/-t11细胞中短暂表达的flag-标记crbn或ywaa突变体使用抗-flagm2琼脂糖珠粒免疫沉淀。所述塞拉蛋白负载的珠粒用缓冲液b洗涤四次,并且然后与在细胞溶解之后用len(10μm)或dmso处理的mm1scrbn-/-t11细胞提取物混合。在4℃下结合过夜之后,所述琼脂糖用缓冲液b洗涤六次。结合蛋白随后通过在sds负载缓冲液中沸腾洗提,通过sds-page溶解并且通过免疫印迹分析检测。
体外结合和泛素化测定
293ftcrbn缺失t11细胞用编码myc-标记塞拉蛋白(crbn)或塞拉蛋白突变体(ywaa)、ha-标记ikzf1的质粒,或用空白载体(ev)短暂转染。48小时后,所述细胞用冰冷pbs洗涤两次并且溶解在缓冲液b中。在不存在或存在len(2μm)或dmso的情况下,myc-crbn或myc-ywaa细胞提取物与ha-ikzf1提取物混合。抗-myc抗体结合琼脂糖珠粒(西格玛)随后添加到混合的提取物,之后在4℃下培育12小时。作为阴性对照,用于与crbn提取物混合的5%的所述ha-ikzf1提取物与来自所述空白载体细胞的提取物混合,并且然后与抗-ha抗体结合珠粒(西格玛)一起培育。接下来,所述珠粒用缓冲液b洗涤四次,用1×urb缓冲液[50mmtris(ph7.4)、5mmkcl、5mmnaf、5mmmgcl2、0.5mmdtt]洗涤两次,并且然后再悬浮在20μl的含有200ng重组e1(波士顿生物化学(bostonbiochem)、250ng重组ubch5a(波士顿生物化学)、250ng重组ubch5b(波士顿生物化学)、0.4μm泛素醛(波士顿生物化学)、10μgflag泛素(波士顿生物化学)、1×ers(20mm磷酸肌酸、0.2μg/μl肌酸磷酸激酶、5mmmg-atp)、1×蛋白酶/磷酸酶抑制剂(罗氏(roche))、10nmllnl(波士顿生物化学)、10nmmg132(emd生命科学(emdbioscience))、0.5mmatp的1×urb缓冲液中。所述反应在30℃下进行1小时,并且然后通过在sds负载缓冲液中沸腾终止。泛素化产物通过sds-page溶解并且通过免疫印迹分析检测。
体内泛素化测定
所述泛素化测定如先前所描述(30)进行。简单来说,在6孔板中接种的293ft细胞用如在图3c中指定的所述以下质粒短暂转染:pcdna3-ikzf1-v2-v5(1μg)、pcdna3-flag-crbn(1μg)、pcdna3-flag-ywaa(1μg)和pcmv-8×his-ub(0.5μg)。对于每个转染,空白载体pcdna3用于使所述总质粒dna达到4μg。36小时后,细胞用len(2μm)或dmso以及10μmmg132再处理12小时。所述细胞随后用冰冷pbs洗涤两次,刮掉在pbs中的所述板,并且然后通过离心收集。所述细胞的小等分试样溶解在缓冲液a中,并且其余部分溶解在缓冲液c(6m胍-hcl,0.1mna2hpo4/nah2po4、10mm咪唑,ph8.0)中。在超声处理之后,所述整个细胞提取物在室温下与25μl的ni-nta琼脂糖珠粒混合3小时。接下来,所述ni-nta珠粒用缓冲液c洗涤两次,用缓冲液d(1体积的缓冲液c:3体积的缓冲液e)洗涤两次,并且用缓冲液e(25mmtris.cl,20mm咪唑,ph6.8)洗涤一次。结合蛋白随后通过在含有300mm咪唑的1×sds负载的缓冲液中沸腾洗提,通过sds聚丙烯酰胺凝胶电泳溶解,并且通过免疫印迹分析检测。
体内蛋白降解测定
在12孔板中接种的293ft细胞用50ng的表达所述指定orf的plenti-ubc-pgk-hyg或plenti-ubc-pgk-pur慢病毒载体和950ng的相对应的空白豆状病毒载体短暂转染。36小时后,细胞用dmso、len(2μm)或pom(0.2μm)处理12小时。细胞提取物使用缓冲液a收集并且进行免疫印迹分析。
蛋白半衰期分析
对于环己酰亚胺测定,细胞用dmso或len(2μm)预处理1小时,并且然后将100μg/ml环己酰亚胺(西格玛)添加到所述dmem生长培养基中。在其后各个时间点,细胞提取物使用缓冲液a收集并且进行免疫印迹分析。
实时rt-pcr
总rna使用具有柱上dnase消化的凯杰(qiagen)rneasy迷你试剂盒提取。总rna使用具有随机引物的affinityscriptqpcrcdna合成试剂盒(安捷伦)逆转录成第一链cdna。实时pcr使用rt2sybrgreen/roxqpcrmastermix(凯杰)和mx3000pqpcr系统(stratagene)进行两次重复。将值平均以计算所述表达水平并且针对rps18的所述水平归一化。pcr引物如下:
rps18for,5′-ttcggaactgaggccatgat-3′(seqidno:5)
rps18rev,5′-tttcgctctggtccgtcttg-3′(seqidno:6)
ikzf1for,5′-cccctgtaagcgatactcca-3′(seqidno:7)
ikzf1rev,5′-tgggagccattcattttctc-3′(seqidno:8)
ikzf3for,5′-tcggagatggttccagttatca-3′(seqidno:9)
ikzf3rev,5′-attctggcgttcttcatggtt-3′(seqidno:10)
irf4for,5′-gcggtgcgctttgaacaag-3′(seqidno:11)
irf4rev,5′-acactttgtacgggtctgaga-3′(seqidno:12)
慢病毒shrna载体
将靶向所关注的所述mrna的合成互补寡核苷酸配对杂交并且如下亚克隆:靶向crbn的寡核苷酸或对照寡核苷酸对(shcntl)接合到plko-tet-on-puro中(31)。靶向ikzf1和ikzf3的寡核苷酸和shcntl接合到plko-rfp(由朱莉洛斯曼(julielosman)博士赠送)中。靶向序列如下列出:
shcntl,5′-caacaagatgaagagcaccaa-3′(seqidno:13);
shcrbn-1,5′-gcccacgaatagttgtcattt-3′(seqidno:14)
shcrbn-2,5′-gcttgcaacttgaatctgata-3′(seqidno:15);
shikzf1-1,5′-gcatttggaaacgggaataaa-3′(seqidno:16);
shikzf1-2,5′-ctacgagaaggagaacgaaat-3′(seqidno:17);
shikzf1-3,5′-ccgcttccacatgagctaaag-3′(seqidno:18);
shikzf3-1,5′-gcctgaaatcccttacagcta-3′(seqidno:19);
shikzf3-2,5′-gtaacctcctccgccacatta-3′(seqidno:20);
shikzf3-3,5′-gacagtctaagagtaagtaaa-3′(seqidno:21)。
cdna消耗或富集测定
mm1s细胞用plenti-cag-flag-ires-gfp空白载体或表达ikzf1-v1-q146h、ikzf3-q147h、ikzf2-v2或irf4的plenti-cag-flag-ires-gfp载体感染。在感染48小时之后,将2μmlen或dmso添加到所述培养基。每隔一天所述培养基用含有len或dmso的新鲜培养基替换。在其后所述指定的时间点处的gfp+细胞的百分比通过流式细胞测量分析测定。gfp+细胞的百分比的倍数变化通过len处理的细胞的百分比除以dmso处理的细胞的百分比计算。
小发夹rna(shrna)消耗或富集测定
mm1s或kms34细胞用针对ikzf1或ikzf3的表达对照shrna或多种shrna的plko-rfp慢病毒载体感染。两天后,rfp+细胞的所述百分比使用流式细胞仪监测。对于每个shrna的rfp+百分比的所述改变首先针对第2天进行归一化。随后,对于如指定的每个时间点,rfp+细胞的相对百分比针对shrna对照进行归一化。
染色质免疫沉淀
chip如先前所描述进行chip研究,其中使用人类irf4基因座的特异性引物进行若干修改(32)。简单来说,4x107mm1.s细胞用2μmlen或dmso处理24小时并且通过将十分之一体积的11%甲醛溶液(11%甲醛,50mmhepesph7.3,100mmnacl、1mmedtaph8.0、0.5mmegtaph8.0)添加到所述生长培养基在室温下交联10分钟,接着用0.125m甘胺酸淬灭并且用pbs洗涤两次。50μl的dynal蛋白6磁珠(西格玛)用0.5%bsa(w/v)封闭在pbs中。磁珠与10μg的所述抗-ikzf1抗体(bethyl实验室#a303-516a)结合。交联的细胞用溶解缓冲液1(50mmhepes-kohph7.5、140mmnacl、1mmedtaph8.0、10%丙三醇、0.5%np-40和0.25%tritonx-100)溶解并且用溶解缓冲液2(10mmtris-hclph8.0、200mmnacl、1mmedtaph8.0和0.5mmegtaph8.0)洗涤。使用以设定高(high)功率的bioruptor超声发生器,将细胞在溶解缓冲液3(50mmhepes-kohph7.5、140mmnacl、1mmedtaph8.0、1mmegtaph8.0、1%tritonx-100、0.1%na-脱氧胆酸盐和1%sds)中再悬浮和超声处理4×10分钟循环,30秒开/关循环。清洁超声处理的溶解物,用稀释缓冲液(50mmhepes-kohph7.5、140mmnacl、1mmedtaph8.0、1mmegtaph8.0、1%tritonx-100、0.1%na-脱氧胆酸盐)按1:10稀释,并且在4℃下与与抗体结合的磁珠一起培育过夜。珠粒用溶解缓冲液3洗涤两次,用高盐洗液(50mmhepes-kohph7.5、500mmnacl、1mmedtaph8.0、1mmegtaph8.0、1%tritonx-100、0.1%na-脱氧胆酸盐和0.1%sds)洗涤一次,用licl洗涤缓冲液(20mmtris-hclph8.0、1mmedtaph8.0、250mmlicl、0.5%np-40、0.5%na-脱氧胆酸盐)洗涤一次,并且用te缓冲液(10mmtris-hclph8.0、1mmedtaph8.0)洗涤一次。将蛋白酶抑制剂(罗氏complete(rochecomplete))添加到所有溶解并且洗涤缓冲液结合复合物在洗脱缓冲液(50mmtris-hclph8.0、10mmedtaph8.0、1%sds)中在65℃下在间歇涡流下洗提两次维持15min。交联在65℃下逆转过夜。rna和蛋白分别使用rnasea和蛋白酶k消化,并且dna用酚氯仿提取和乙醇沉淀来提纯引物被设计成在所述启动子区和所述转录区的阴性对照区3′内扩增2个位点,:启动子位点1(正向)5′-agttgcaggttgacctacgg-3′(seqidno:22)和(反向)5′-agctttcacccgttgagctt-3′(seqidno:23);启动子位点2(正向)5′-actctcagtttcaccgctcg-3′(seqidno:24)和(反向)5′-ctccgggtcctctctggtat-3′(seqidno:25);阴性对照区1(正向)5′-cgtggctatgtttgcttggg-3′(seqidno:26)和(反向)5′-agcaggcctcttggttgttt-3′(seqidno:27);阴性对照区2(正向)5′-gcagtgctgacactggatct-3′(seqidno:28)和(反向)5′-gcctgccatgcgtaatcaag-3′(seqidno:29)。对于每个样品,富集数据通过计算输入dna的所述免疫沉淀的dna百分比来分析。
细胞增殖测定
将1.5×106个有活力的骨髓瘤细胞以一式三份涂覆在含有len(2μm)或dmso媒剂对照的rpmi1640生长培养基中的10-cm板中。每2天,细胞通过平缓刮擦分离,并且总细胞的一半再涂覆在含有所述相应的试剂(len或dmso)的新鲜rpmi生长培养基中,用于连续培养。在第2天、第4天和第8天,使用viacell细胞存活率计数器(贝克曼库尔特公司(beckmancoulter))计数细胞。
结果
五十年前,沙立度胺用于失眠和孕吐,但是稍后由于其表现为显著的四肢缺陷的致畸性而被抑制。然而,沙立度胺和相关药物来那度胺和泊马度胺(imid)作为免疫调节剂和抗肿瘤药,尤其用于多发性骨髓瘤和其它b细胞恶性病(1-3)已重新获得关注,。尽管如此,基于其致畸和治疗活性的生物化学机理和它们是否相关还是未知的。
就此而言,沙立度胺最近示出结合到塞拉蛋白,其为cullin依赖性泛素接合酶的底物-识别组分,并且抑制其自泛素化活性(4)。用塞拉蛋白吗啉核酸或沙立度胺治疗引起鳍缺陷(4)的斑马鱼,这表明imid通过稳定塞拉蛋白底物起作用。然而,骨髓瘤细胞显现的imid-抗性通常下调塞拉蛋白(5-8)。相反,在骨髓瘤细胞中的高塞拉蛋白浓度与对imid增加的应答性相关(9,10)。共同地,这些观察结果表明imid不仅是塞拉蛋白拮抗剂,而是相反,也可改变塞拉蛋白的所述底物特异性以包含在骨髓瘤中重要的蛋白。
为了寻找此些蛋白,制备编码融合到萤火虫荧光素酶(fluc)的15,483开放阅读框(orf)的质粒文库,已知此些融合的稳定性通常受用于所述相对应的未融合orf的所述(一或多种)泛素接合酶影响(11-13)。处于标准化目的海肾荧光素酶(rluc)报导基因插入到每个orf-荧光素酶cdna中并且将两个报道基因放置在内部核糖体进入位点(ires)对照下(图1a)。
在试验性实验中,在多孔板中生长的293ft胚胎肾细胞用所述orf-荧光素酶文库(每孔一个orf)转染并且用所述蛋白酶体抑制剂mg132、所述羟化酶抑制剂二甲基草酰甘氨酸(dmog),或媒剂处理。36到48小时后测量的fluc/rluc值在输入质粒浓度的大范围内是稳定的(图5)。正如期望,mg132稳定许多蛋白酶体底物和dmog稳定hif1α,其在脯胺酰基羟基化时快速降解(图6)。
接下来,此方法用于识别在用来那度胺处理的293ft细胞中蛋白稳定性的改变(图1a)。总共2113种orf-荧光素酶融合产生不可检测的或高度可变(>50%sd)的荧光素酶信号,留下13,370种用于分析。正如期望,大部分orf不受来那度胺影响(图1b)。根据所述平均值>3sd的所述107种orf(在来那度胺处理之后分别显示降低或增加的fluc/rluc比率的46种orf加61种orf)在第二次测定中再测试。积极地再测试一个下调orf(ikzf3)和一个上调orf(c11orf65)。
当c11orf65融合到血球凝集素(ha)表位标签而不是fluc时其不受来那度胺影响,并且因此没有进一步研究。相比之下,来那度胺下调ikzf3和其旁系同源物ikzf1(其在所述初筛选中刚好已落在3-sd截止值的外部)融合到fluc或ha任一者(图1b和1c)。这些效果为特异性的,因为来那度胺不影响外源性ikzf2、ikzf4、ikzf5,或所述b细胞转录因子irf4(图1c)。在ikzf1和ikzf2两种常见剪接变体(v1和v2)的情况下(图1c)和在泊马度胺的情况下(图7)获得类似的结果。外源性ikzf1的下调通过mg132和通过mln4924阻止,这抑制cullin-依赖性泛素接合酶(图1d)(14,15)。与这些发现一致,除非所述细胞用mg132或mln4924预处理(图1e),否则来那度胺下调在u937白血病细胞中不表达ikzf3的内源性ikzf1,和在mm1s和l363骨髓瘤细胞中的ikzf1和ikzf3两者(图1e)。多个ikzf1带可能由于替代性剪接而通过免疫印迹分析检测。来那度胺不改变ikzf1和ikzf3mrna含量,与它转译后作用一致(图8)。
在具有多西环素-诱导性短发夹rna(shrna)的293ft细胞中下调塞拉蛋白通过来那度胺预防外源性ha-标记的ikzf1的不稳定(图2a)。类似地,在u937细胞(u937)和骨髓瘤细胞(l363和kms34)中,塞拉蛋白shrna通过来那度胺阻断内源性ikzf1的所述下调。成簇规律间隔短回文重复序列(crispr)类基因编辑(16,17)还用于产生crbn-/-293ft细胞,其随后被转染以产生融合到fluc(图2b,上图)或ha(图2b,下图)的ikzf1。在crbn-/-293ft细胞中外源性ikzf1并未下调(图2b)。此缺陷通过野生型塞拉蛋白,而不是抗来那度胺塞拉蛋白突变体(ywaa)修复(4)(图2b)。用第二crbn-/-293ft亚克隆,但是不以具有可检测量的塞拉蛋白的亚克隆获得类似结果。此外,在用crispr产生的两种独立crbn-/-mm1s骨髓瘤细胞系中,内源性ikzf1和ikzf3不通过来那度胺降解(图2c和2d)。
在使用mg132-处理的293ft细胞的共转染实验中,来那度胺提高izkf1和ikzf3而不是ikzf2和ikzf5结合到所述塞拉蛋白泛素接合酶。接下来,flag-标记ikzf1和ikzf2从用或不用来那度胺处理的crbn-/-细胞中免疫沉淀。所述固定免疫沉淀物随后用于捕获来自crbn+/+细胞的内源性塞拉蛋白(图3a)或来自经转染产生野生型塞拉蛋白或所述ywaa变体的crbn-/-细胞的外源性塞拉蛋白(图3b)。在两种情况下,产生塞拉蛋白的所述细胞在溶解之前用或不用来那度胺处理。野生型塞拉蛋白而非所述ywaa变体特异性地结合到ikzf1,其条件是它曝露于来那度胺,与直接结合到塞拉蛋白而不是结合到ikzf1的来那度胺一致(图3a和3b)。当直接添加到用细胞提取物进行的结合测定时,来那度胺还促进塞拉蛋白结合到外源性ikzf1和结合到内源性ikzf1和ikzf3。此外,野生型塞拉蛋白而非所述ywaa变体促进ikzf1在暴露于来那度胺之后体内(图3c)和体外(图3d)的所述泛素化。
分析一系列ikzf1/2嵌合体并且确定对应于结合到塞拉蛋白的来那度胺-依赖性介导的ikzf1(v2)的残基108到197的ikzf1的所述区域。在此区内,在ikzf1和ikzf2之间仅有七个胺基酸差。将ikzf1残基q146(或ikzf3q147)改变成在ikzf2(组胺酸)中的所述相对应的残基消除塞拉蛋白结合和来那度胺-诱导的降解。相反,在ikzf2中的所述往复改变显现出它对来那度胺部分敏感。
接下来,测试六个骨髓瘤细胞系其对体外来那度胺的敏感性(图4a和4b)。先前的研究至少间接示出来那度胺下调irf4,并且将这与其抗骨髓瘤活性相关(5-8)。mm1s、kms34和l363细胞对体外来那度胺敏感而kms11、rpmi8226和ocimy5细胞相对具有抗性(图4b)。在所述三种敏感系中,ikzf1和ikzf3通过来那度胺来下调(图4a)。在这些系中的两种(mm1s和kms34)中,ikzf1和ikzf3的损耗之后,irf4降低,与在这些细胞中ikzf1和/或ikzf3的下游起作用的irf4一致(图4a)。通过在用来那度胺处理的mm1s细胞中的染色质免疫沉淀(chip)证实,irf4mrna和ikzf1结合到所述irf4基因座降低。所述第三敏感细胞系l363,表达不受来那度胺影响的高基础量的irf4,提供此药物的所述抗增生效果涉及除irf4外的至少一种靶标的证据(图4a)。
相比于所述敏感系,所述抗性系中的两种具有相对高基础量的的ikzf1(ocimy5)或ikzf3(kms11)和相对应低量的塞拉蛋白,并且通过来那度胺下调ikzf1和ikzf3在第三(rpmi8226)中减弱(图4a)。在所述三种抗性系中irf4不通过来那度胺下调。
接下来,用其中ikzf1或ikzf3用shrna遏制或通过表达ikzf1或ikzf3的抗来那度胺形式来提高的细胞进行竞争实验。与表达对照shrna的细胞相比,在所述来那度胺-敏感细胞系mm1s和kms34中的ikzf1或ikzf3任一者的下调大大地降低细胞适合性并且与irf4的下调相关(图4c和4d)。值得注意地,ikzf蛋白任一者的下调导致另一ikzf蛋白的损耗。相反,ikzf1(q146h)或ikzf3(q147h)的所述稳定形式的表达对mm1s细胞(图4e和4f)和kms34细胞赋予来那度胺抗性。天然地对来那度胺具有抗性(图1c)的t细胞特异性ikaros家庭成员(ikzf2)的异位表达具有类似的效果。表达irf4自身的所述效果非常不明显,再次表明ikzf1和ikzf3具有与来那度胺的抗骨髓瘤活性相关的附加靶标(图4e)。仍然要看通过ikzf家族成员赋予的抗来那度胺是否主要由于其靶基因的转录激活或非标准功能。
所述发现来那度胺的抗骨髓瘤活性与ikzf1和ikzf3的下调有关,两种转录因子在b细胞发展中起重要作用并且在b细胞恶性肿瘤(包含骨髓瘤)中高度表达(18-21)。存在变得对限定细胞谱系的转录因子成瘾的癌症的许多其它实例(22,23)。虽然在一些其它b细胞恶性肿瘤中ikzf1为肿瘤抑制剂(24),但是对在不同背景中充当肿瘤抑制剂或致癌基因任一者的所述相同基因存在优先权。
ikaros家族成员在不同环境中可充当转录活化剂或抑制剂。例如,在t细胞中ikzf1和ikzf3抑制介白素-2(il-2)表达,因此解释imid如何诱导il-2在体内产生(19,25,26)。
所述蛋白酶体抑制剂硼替佐米单独和与来那度胺组合具有抗骨髓瘤活性,但是所述切合蛋白酶体底物有争议(27,28)。这之所以产生悖论,是因为蛋白酶体阻断通过来那度胺预防ikzf1和ikzf3的破坏。通过硼替佐米的蛋白酶体阻断不完全具有治疗剂量,然而,这可使得充分清除ikzf1和ikzf3同时保持硼替佐米的其它有益效果。还可能的是,在多泛素化后这两种蛋白为惰性或显性失活。
先前工作表明,沙立度胺的致畸效果反映塞拉蛋白失活,而这些发现指示所述imid的所述治疗作用反映塞拉蛋白功能增加。值得注意地,塞拉蛋白可具有附加的底物,其不在所述融合文库中,可不被识别为荧光素酶融合,或需要在293ft细胞中缺乏的辅助蛋白或信号。无论如何,所述发现产生解耦所述imid的所述治疗和致畸活性的路径。
还不清楚来那度胺对塞拉蛋白的效果是否为超效等位基因或新效等位基因。由雷帕霉素提供对于所述后者的优先权,所述雷帕霉素将fkbp12转化成torc1激酶抑制剂和环孢灵,将环孢素a受体转化成钙调神经磷酸酶拮抗剂(29)。目前视为不可成药的可能的癌蛋白,如c-myc或β-连环蛋白可通过像来那度胺、重定的泛素接合酶的药物破坏。
参考文献
1.r.martiniani,v.diloreto,c.disano,a.lombardo,a.m.liberati,来那度胺的生物活性和其在多发性骨髓瘤中的基础治疗作用(biologicalactivityoflenalidomideanditsunderlyingtherapeuticeffectsinmultiplemyeloma),《血液学进展(advhematol)》2012,842945(2012)。
2.e.terpos,n.kanellias,d.christoulas,e.kastritis,m.a.dimopoulos,泊马度胺:治疗复发和难治性多发性骨髓瘤的新颖药物(pomalidomide:anoveldrugtotreatrelapsedandrefractorymultiplemyeloma),《肿瘤靶向和治疗(oncotargetsandtherapy)》6,531(2013)。
3.y.x.zhu,k.m.kortuem,a.k.stewart,在多发性骨髓瘤中的免疫调节药物沙立度胺、来那度胺和泊马度胺的分子作用机制(molecularmechanismofactionofimmune-modulatorydrugsthalidomide,lenalidomideandpomalidomideinmultiplemyeloma)《白血病和淋巴瘤(leukemia&lymphoma)》54,683(2013年4月)。
4.t.ito等人,沙立度胺致畸性的主要靶向的识别(identificationofaprimarytargetofthalidomideteratogenicity),《科学》327,1345(2010年3月12日)。
5.a.lopez-girona等人,塞拉蛋白为用于来那度胺和泊马度胺的免疫调节和抗增生活性的直接蛋白靶向(cereblonisadirectproteintargetforimmunomodulatoryandantiproliferativeactivitiesoflenalidomideandpomalidomide),《白血病(leukemia)》26,2326(2012年11月)。
6.l.h.zhang等人,在激活的b细胞类亚型弥漫性大b细胞淋巴瘤中的来那度胺功效取决于irf4和塞拉蛋白表达(lenalidomideefficacyinactivatedb-cell-likesubtypediffuselargeb-celllymphomaisdependentuponirf4andcereblonexpression),《英国血液学杂志(brjhaematol)》160,487(2013年2月)。
7.y.yang等人,采用用于abc弥漫性大b细胞淋巴瘤的治疗的合成致死率(exploitingsyntheticlethalityforthetherapyofabcdiffuselargebcelllymphoma),《癌细胞(cancercell)》21,723(2012年6月12日)。
8.y.x.zhu等人,来那度胺和泊马度胺的抗骨髓瘤活性需要塞拉蛋白表达(cereblonexpressionisrequiredfortheantimyelomaactivityoflenalidomideandpomalidomide),《血液(blood)》118,4771(2011年11月3日)。
9.a.broyl等人,高塞拉蛋白表达与在用沙立度胺维持治疗的新诊断的多发性骨髓瘤患者中的较好存活率相关(highcereblonexpressionisassociatedwithbettersurvivalinpatientswithnewlydiagnosedmultiplemyelomatreatedwiththalidomidemaintenance),《血液》121,624(2013年1月24日)。
10.d.heintel等人,塞拉蛋白(crbn)的高表达与在患有用来那度胺和地塞米松治疗的多发性骨髓瘤的患者中改善的临床应答相关(highexpressionofcereblon(crbn)isassociatedwithimprovedclinicalresponseinpatientswithmultiplemyelomatreatedwithlenalidomideanddexamethasone),《英国血液学杂志》161,695(2013年6月)。
11.g.j.zhang等人,体内cdk2抑制的生物发光成像(bioluminescentimagingofcdk2inhibitioninvivo.)《自然·医学(natmed)》10,643(2004年6月)。
12.m.safran等人,用于hif脯胺酰基羟化酶活性的非侵入性成像的小鼠模型:对刺激红血球生成素产生的口服剂的评估(mousemodelfornoninvasiveimagingofhifprolylhydroxylaseactivity:assessmentofanoralagentthatstimulateserythropoietinproduction),《美国国家科学院院刊》103,105(2006年1月3日)。
13.h.c.yen,q.xu,d.m.chou,z.zhao,s.j.elledge,在哺乳动物细胞中的总体蛋白稳定性分布(globalproteinstabilityprofilinginmammaliancells),《科学》322,918(2008年11月7日)。
14.t.a.soucy等人,作为治疗癌症的新方法的nedd8-活化酶的抑制剂(aninhibitorofnedd8-activatingenzymeasanewapproachtotreatcancer),《自然》458,732(2009年4月9日)。
15.m.ohh等人,在哺乳动物细胞中的cullin依赖性泛素化需要完整nedd8路径(anintactnedd8pathwayisrequiredforcullin-dependentubiquitylationinmammaliancells),《欧洲分子生物学学会报告(emboreports)》3,177(2002年2月)。
16.l.cong等人,使用crispr/cas系统的多重基因组工程(multiplexgenomeengineeringusingcrispr/cassystems),《科学》339,819(2013年2月15日)。
17.p.mali等人,经由cas9的rna引导的人类基因组工程(rna-guidedhumangenomeengineeringviacas9),《科学》339,823(2013年2月15日)。
18.m.merkenschlager,在免疫受体信令、淋巴细胞分化和功能中的ikaros(ikarosinimmunereceptorsignaling,lymphocytedifferentiation,andfunction),《欧洲生物化学学会联合会快报(febslett)》584,4910(2010年10月15日)。
19.e.c.thompson等人,作为b细胞发育阶段特异性调节电路的一体式组分的ikarosdna结合蛋白(ikarosdna-bindingproteinsasintegralcomponentsofbcelldevelopmental-stage-specificregulatorycircuits),《抗扰性(immunity)》26,335(2007年3月)。
20.i.ferreiros-vidal等人,ikaros靶向的全基因组识别阐明其对小鼠b细胞谱系标准和b细胞分化前的工作成果(genome-wideidentificationofikarostargetselucidatesitscontributiontomouseb-celllineagespecificationandpre-b-celldifferentiation),《血液》121,1769(2013年3月7日)。
21.s.monticelli,f.sallusto,采用中心级的负调节剂(negativeregulatorstakecenterstage),《自然免疫学(natureimmunology)》13,719(2012年8月)。
22.l.a.garraway,w.r.sellers,在人类癌症中的谱系依赖性和谱系存活致癌基因(lineagedependencyandlineage-survivaloncogenesinhumancancer),《自然评论:癌症(natrevcancer)》6,593(2006年8月)。
23.s.p.shah等人,在卵巢的粒层细胞肿瘤中的foxl2的突变(mutationoffoxl2ingranulosa-celltumorsoftheovary),《新英格兰医学杂志(nengljmed)》360,2719(2009年6月25日)。
24.p.kastner等人,作为在b细胞急性淋巴母细胞白血病中的肿瘤抑制的ikaros的功能(functionofikarosasatumorsuppressorinbcellacutelymphoblasticleukemia),《美国血液研究期刊(americanjournalofbloodresearch)》3,1(2013)。
25.f.j.quintana等人,aiolos通过直接沉默il2表达促进th17分化(aiolospromotesth17differentiationbydirectlysilencingil2expression),《自然免疫学(natureimmunology)》13,770(2012年8月)。
26.n.avitahl等人,用于t细胞激活和调节染色体增值的ikaros设置阈值(ikarossetsthresholdsfortcellactivationandregulateschromosomepropagation),《抗扰性》10,333(1999年3月)。
27.j.laubach,p.richardson,k.anderson,多发性骨髓瘤(multiplemyeloma),《医学年评(annurevmed)》62,249(2011)。
28.p.g.richardson等人,用于复发和复发/难治性多发性骨髓瘤的来那度胺加硼替佐米多的中心i期剂量升级试验(multicenter,phasei,dose-escalationtrialoflenalidomideplusbortezomibforrelapsedandrelapsed/refractorymultiplemyeloma),《临床肿瘤学杂志(jclinoncol)》27,5713(2009年12月1日)。
29.g.r.crabtree,s.l.schreiber,三个部分的发明:胞内信令和诱导的邻近性(three-partinventions:intracellularsignalingandinducedproximity),《生化科学趋势(trendsbiochemsci)》21,418(1996年,11月)。
30.m.r.campanero,e.k.flemington,通过泛素-蛋白酶体依赖性衰退调节e2f:通过prb肿瘤抑制蛋白稳定(regulationofe2fthroughubiquitin-proteasome-dependentdegradation:stabilizationbytheprbtumorsuppressorprotein),《美国国家科学院院刊》94,2221(1997年3月18日)。
31.d.wiederschain等人,用于肿瘤学靶向验证的单个载体诱导性慢病毒rnai系统(single-vectorinduciblelentiviralrnaisystemforoncologytargetvalidation),《细胞周期(cellcycle)》8,498(2009年2月1日)。
32.c.j.ott等人,bet溴结构域抑制靶向在高风险急性淋巴母细胞白血病中的c-myc和il7r两者(betbromodomaininhibitiontargetsbothc-mycandil7rinhigh-riskacutelymphoblasticleukemia),《血液》120,2843(2012年10月4日)。
33.k.kondo,j.klco,e.nakamura,m.lechpammer,w.g.kaelin,需要抑制hif用以通过vonhippel-lindau蛋白的肿瘤抑制(inhibitionofhifisnecessaryfortumorsuppressionbythevonhippel-lindauprotein),《癌细胞》1,237(2002年,4月)。
34.j.loven等人,通过破坏超级增强子选择性抑制肿瘤致癌基因(selectiveinhibitionoftumoroncogenesbydisruptionofsuper-enhancers),《细胞(cell)》153,320(2013年4月11日)。
- 还没有人留言评论。精彩留言会获得点赞!