少突胶质细胞祖细胞组合物的制作方法
本申请要求2016年3月30日提交的题为“少突胶质细胞祖细胞组合物”的美国临时专利申请系列号62/315,454的申请日优先权,其内容通过引用全文纳入本文。
本公开涉及少突胶质细胞祖细胞的细胞生物学领域。更具体地,本公开涉及包含少突胶质细胞祖细胞的组合物,以及其制备和使用方法。
背景技术:
当培养多潜能细胞(包括人胚胎干细胞(hesc))时,在其扩增期间可发生不同程度的自发分化。这种自发分化随后可损害hesc经历定向分化成特定细胞类型,包括少突胶质细胞祖细胞(opc)的能力。例如,先前已显示hesc的h1系在常规培养条件下生长时经过自发分化,具有滋养外胚层谱系分化的倾向(drukkerm,tangc,ardehalir,rinkevichy,seitaj,leeas,mosleyar,weissmanil,soeny.“从人多潜能干细胞中分离原始内胚层,中胚层,血管内皮和滋养层祖细胞(isolationofprimitiveendoderm,mesoderm,vascularendothelialandtrophoblastprogenitorsfromhumanpluripotentstemcells)”,natbiotechnol.2012年5月27日;30(6):531-42;wangz,orone,nelsonb,raziss,ivanovan.“nanog、oct4和sox2在人胚胎干细胞中的不同谱系规范作用(distinctlineagespecificationrolesfornanog,oct4,andsox2inhumanembryonicstemcells)”,cellstemcell.2012年4月6日;10(4):440-54)。这种自发分化部分由hesc内的内源性wnt信号传导调节(kumarrm,cahanp,shalekak,satjjar,daleykeyseraj,lih,zhangj,pardeek,gennertd,trombettajj,ferrantetc,regeva,daleygq,collinsjj.“解构多潜能干细胞中的转录异质性(deconstructingtranscriptionalheterogeneityinpluripotentstemcells)”,nature.2014年12月4日;516(7529):56-61)。然而,该领域在关于wnt途径的激活或抑制是否有益于控制分化方面存在分歧。即,kurek等表明抑制wnt途径会减少自发分化(kurekd,neagua,tastemelm,tüysüzn,lehmannj,vandewerkenhj,philipsens,vanderlindenr,maasa,vanijckenwf,drukkerm,tenberged.“内源性wnt信号介导外胚层干细胞和人胚胎干细胞的bmp诱导的和自发分化(endogenouswntsignalsmediatebmp-inducedandspontaneousdifferentiationofepiblaststemcellsandhumanembryonicstemcells)”,stemcellreports.2015年1月13日;4(1):114-28)。
当h1hesc扩增然后定向分化成opc时,分化细胞表现出滋养外胚层相关基因(包括转录因子)的表达增加。这表明神经外胚层谱系外的细胞类型能够在分化期间持续存在。继而,在分化期间这种非神经外胚层谱系标志物的持续与最终opc群中不需要的细胞类型,包括例如上皮细胞,软骨细胞祖细胞和视网膜色素上皮细胞相关。
已经使用几种标志物来量化opc群中不需要的细胞的水平。即,可以通过细胞表型分析方法如流式细胞术和基因表达谱分析来检测这些标志物。例如,流式细胞术分析可用于基于与上皮细胞相关的标志物的存在来检测不同水平的上皮细胞,包括例如epcam,cd49f/itga6,e-钙粘蛋白,细胞角蛋白7(k7),泛细胞角蛋白(pck),ca125/muc16,内皮素/串珠蛋白聚糖,以及表1中列出的其他标志物。此外,通过定量聚合酶链反应(qpcr)的基因表达分析可用于基于olrl和rpe65表达指示不同水平的软骨细胞祖细胞和视网膜色素上皮细胞。
尽管已经努力产生具有低水平的不期望的细胞类型的opc群,但是诸如细胞分选和抗体消耗的策略是复杂的并且经常需要产生昂贵且不可放大的定制试剂。
技术实现要素:
本公开的一个方面包括包含多个少突胶质细胞祖细胞(opc)的组合物,以及其制备方法和用于改善需要治疗的对象的一种或多种神经功能的方法。在本公开的一个方面,本公开包括含有细胞群的组合物,所述细胞群包含多个opc和少于15%的不期望的细胞类型。在本公开的一个方面,本公开还包括实现细胞群的方法,所述细胞群包含多个opc和少于15%的不期望的细胞类型。在本公开的一个方面,本公开还包括表征细胞群的方法,所述细胞群包含多个opc和少于15%的不期望的细胞类型。另外,在本公开的一个方面,本公开还包括使用细胞群的方法,所述细胞群包含多个opc和少于15%的不期望的细胞类型。在本公开的一个方面,本公开还包括产生细胞群的方法,所述细胞群包含多个opc和少于15%的不期望的细胞类型。
更具体地,在一个方面,本公开包括含有组合物的容器,其中所述组合物包含含有多个少突胶质细胞祖细胞的细胞群,并且其中所述细胞群包含少于15%的不期望的细胞类型。在某些方面,细胞群包含少于15%的上皮谱系细胞。在某些方面,细胞群包含少于2%的k7阳性细胞。在某些方面,细胞群包含少于5%的k7阳性细胞。
本公开的一个方面是包含组合物的容器,其中所述组合物包含含有多个少突胶质细胞祖细胞(opc)的细胞群,并且其中所述多个opc包含一个或多个干细胞源的体外衍生后代,所述干细胞源选自人胚胎干细胞,灵长类动物多潜能干细胞和诱导多潜能干细胞。
本公开的另一方面是包含组合物的容器,其中所述组合物包含包含多个少突胶质细胞祖细胞的细胞群,并且其中所述细胞群能够在囊肿试验中形成小于或等于1个上皮囊肿/100000个细胞。在另一方面,在将多至20×106个细胞植入中枢神经系统损伤部位后,细胞群能够在少于2%的对象中产生异位组织。
本公开的另一个方面是包含组合物的容器,其中所述组合物包含含有多个少突胶质细胞祖细胞的细胞群,并且其中所述细胞群可用于治疗中风,脊髓损伤和/或多发性硬化症。
附图说明
本专利或申请文件包含至少一幅有色附图。本专利或专利申请公开与彩色附图的副本将根据要求,在支付所需的费用之后由政府机关提供。
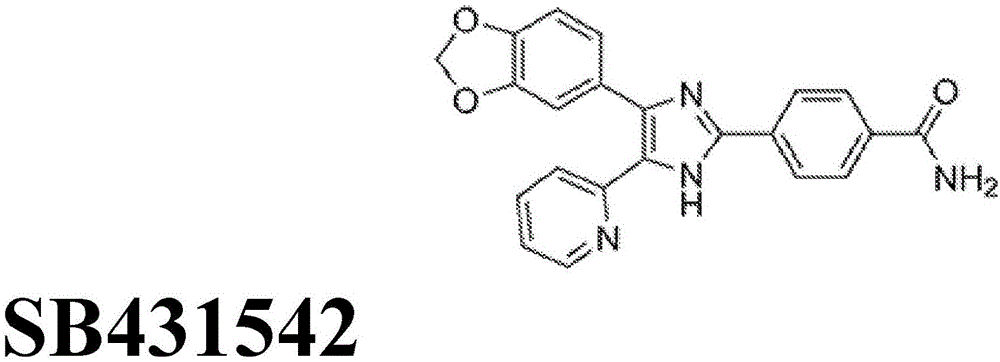
图1显示了根据本发明的sb431542的化学结构;
图2显示了根据本发明的背吗啡(dorsomorphin)的化学结构;
图3显示了根据本发明的chir99021的化学结构;
图4显示了根据本发明的嘌呤胺的化学结构;
图5显示了与通过不预处理未分化细胞的方法产生的匹配对照相比,通过根据本公开内容的实施方式的方法产生的opc中表达的ng2,k7和pck标志物水平变化的代表性比较。
图6a,左图和中图是根据本发明的通过不预处理未分化细胞的方法产生的h1hesc衍生的opc的代表性象形图,其显示了根据本发明的体外囊肿试验中的各种水平的囊肿形成;
图6a,右图是通过包括根据本发明预处理未分化细胞的方法产生的h1hesc衍生的opc的代表性象形图,显示在根据本发明的体外囊肿试验中没有囊肿形成;
图6b显示了颈脊髓损伤和给予根据本发明的通过不预处理未分化细胞的方法产生的h1hesc衍生的opc后9个月的成年雌性大鼠的一组代表性组织学;
图6c是通过不预处理未分化细胞的方法产生的几个opc群的体内囊肿形成频率与体外囊肿计数的线性回归图;
图7显示了根据本发明使用包括预处理未分化细胞的方法产生的opc植入的大鼠颈脊髓的代表性显微照片;
图8显示了根据本发明的用于测试移植的opc在白质中风的小鼠模型中的作用的实验时间线的非限制性实例;
图9显示了从网格步行测试产生的预期结果的非限制性实例,证明了移植有通过根据本公开的实施方式的方法产生的opc的中风损伤小鼠的改善表现;
图10显示了从圆柱测试产生的预期结果的非限制性实例,证明了移植有通过根据本公开的实施方式的方法产生的opc的中风损伤小鼠的改善表现;
图11是步态参数的代表性第一主成分分析,其显示了根据本发明的通过不预处理未分化细胞的方法产生的opc移植的受损大鼠中的运动活性的改善;
图12是平均跑动速度的代表性曲线图,其显示根据本发明的通过不预处理未分化细胞的方法产生的opc移植的脊髓损伤大鼠的跑动速度增加;
图13是右后步频率的代表性图,显示了根据本发明的通过不预处理未分化细胞的方法产生的opc移植的脊髓损伤大鼠的运动损伤减少;
图14是平均右前方最大纵向偏差的代表性图,显示了根据本发明的通过不预处理未分化细胞的方法产生的opc移植的脊髓损伤大鼠中受影响肢体的纵向位移的恢复;
图15是根据本发明的通过不预处理未分化细胞的方法产生的opc注射后4个月的opc移植物的代表性截面;
图16显示了根据本发明的用于测试移植的opc在多发性硬化的大鼠模型中的作用的实验时间线的非限制性实例;
图17是在通过根据本公开内容的实施方式的方法产生的opc移植后产生的预期脑脊髓炎(eae)评分的图的非限制性实例。
具体实施方式
该描述不旨在作为可以实现本公开的所有不同方式,或者可以添加到本公开的所有特征的详细目录。例如,关于一个方面示出的特征可以结合到其他方面中,并且可以从该方面删除关于特定方面示出的特征。因此,本公开预期在本公开的一些方面,可排除或省略本文中阐述的任何特征或特征组合。另外,根据本公开,本领域技术人员将清楚对本文提出的各个方面的许多变化和添加,其不脱离本公开。在其他情况下,没有详细显示公知的结构,接口和过程,以免不必要地遮掩本发明。本说明书的任何部分都不应被解释为对本发明的全部范围的任何部分的否定。因此,以下描述旨在说明本公开的一些特定方面,而不是穷举地指定其所有排列,组合和变化。
除非另外定义,否则,本文中所使用的所有技术和科学术语都具有本发明所属领域普通技术人员通常所理解的同样含义。本发明的说明书所用术语仅仅用来描述具体方面,而不是用于限制本发明。
本文引用的所有出版物、专利申请、专利和其他参考文献都通过引用全文纳入本文。
除非另有说明,需要具体说明的是本文描述的本发明的各种特征可以以任意组合方式使用。此外,本公开还预期在本公开的一些方面,可排除或省略本文中阐述的任何特征或特征组合。
本文公开的方法可包括用于实现所述的方法的一个或多个步骤或动作。在不脱离本发明的范围的情况下,方法步骤和/或动作可以彼此互换。换句话说,除非对于方面的正确操作需要特定顺序的步骤或动作,否则可以修改特定步骤和/或动作的顺序和/或使用而不脱离本发明的范围。
如在本公开和所附权利要求的描述中所使用的,单数形式的“一个”,“一种”和“该”也包括复数的指代物,除非文本中有另外的明确表示。
如本文所述,“和/或”表示涵盖了任何以及所有可能的一种或多种相关所列项目的组合,以及当在可选情况下解释时(“或”)缺少组合。
本文所用术语“约”和“近似”在指示诸如百分比,密度,体积等可测量值时,表示涵盖了该特定量的±20%,±10%,±5%,±1%,±0.5%或者甚至±0.1%的变异。
如本文所用,诸如“在x和y之间”和“在约x和y之间”的短语应该被解释为包括x和y。如本文所用的,诸如“在约x和y之间”的短语表示“在约x和约y之间”并且诸如“从约x到y”的短语表示“从约x到约y”。
本文所用的术语“少突胶质细胞祖细胞(opc)”指这样的神经外胚层/胶质谱系的细胞,其具有中枢神经细胞中存在的细胞类型的特征,并且能够分化成少突胶质细胞。这些细胞通常表达特征标志物巢蛋白、ng2和pdgr-rα。
如本文所用,短语“异位组织”是指具有不想要的或意外的特征的组织。当在定义包含opc的组合物的上下文中使用时,“异位组织”是指不是源自神经外胚层谱系的组织。更具体地,“异位组织”是类似于上皮,上皮囊肿,间皮衍生组织,软骨,骨的组织或其他通常不在中枢神经系统中发现的组织。
如本文所用,术语“不期望的细胞类型”是指神经外胚层谱系外的细胞,其在植入时导致异位组织的形成,或导致在囊肿试验中形成一个或多个囊肿,如本文所述。更具体地,“不期望的细胞类型”包括表达k7和/或pck标志物的细胞。在一个方面,“不期望的细胞类型”可包括上皮谱系细胞。在一个方面,“不期望的细胞类型”可以包括表达作为滋养细胞谱系特征的标志物(例如hand1)的细胞。
术语“k7”,“角蛋白7”和“细胞角蛋白7”在本文中可互换使用,并且是指由krt7基因或其任何变体编码的蛋白质。
术语“pck”和“泛细胞角蛋白”在本文中可互换使用,并且广泛地指细胞角蛋白家族的任何成员,包括但不限于细胞角蛋白的酸性和碱性(i型和ii型)亚家族,及其变体。pck蛋白的非限制性实例包括由ael/ae3单克隆抗体混合物(密理博目录号mab3412)结合的那些蛋白质。
如本文所用,“上皮谱系细胞”是指衍生自外胚层的发育前体,但是已经与神经外胚层/胶质谱系分开的细胞。在一个方面,“上皮谱系细胞”可以通过表1中列出的一种或多种标志物鉴定。这些细胞包括已经历上皮-间充质转变(emt)的发育后代和来自滋养细胞的上皮样细胞。
表1.上皮细胞标志物。
如本文所用,短语“细胞富集”是指纯化所需的细胞类型(在这种情况下是opc)远离不需要的细胞类型。纯化可以是阳性选择(靶向opc)或阴性选择(靶向不需要的细胞类型)。抗体可用于结合并物理除去靶向的细胞类型。抗体可以与固体表面偶联以实现物理分离。固体表面通常是磁珠,柱或烧瓶。
如本文所用,“植入”或“移植”是指使用合适的递送技术(例如,使用注射装置)将细胞群给予到靶组织中。
如本文所用,“对象”是指动物或人。
如本文所用,“有此需要的对象”是指在中枢神经系统中具有受损组织的动物或人。在一个方面,动物或人正在经历运动功能丧失。
本文中可互换使用的术语“中枢神经系统”和“cns”是指控制身体的一种或多种活动的神经组织的复合物,其包括但不限于脊椎动物中的脑和脊髓。
如本文所用,关于病症或疾病的“治疗”或“处理”是获得有益或所需结果,包括优选在患者中病症或疾病表现后的临床结果的方法。关于疾病的有益或期望的结果包括但不限于以下一种或多种:改善与疾病相关的病症,治愈疾病,减轻疾病的严重性,延迟疾病的进展,减轻与疾病相关的一种或多种症状,提高患有疾病的人的生活质量,延长生存期,以及其任何组合。同样地,出于本公开的目的,关于病症的有益或期望的结果包括但不限于以下一种或多种:改善病症,治愈病症,减轻病症的严重性,延迟病症的进展,减轻与病症相关的一种或多种症状,提高患有病症的人的生活质量,延长生存期,以及其任何组合。
分化多潜能干细胞的方法
本公开的一个方面包括分化多潜能干细胞的方法。一方面,提供了产生包含多个神经细胞的细胞群的方法。一方面,提供了一种产生包含多个opc的细胞群的方法。一方面,提供了产生细胞群的方法,所述细胞群包含多个opc,所述opc是人胚胎干细胞的体外分化后代。一方面,提供了产生细胞群的方法,所述细胞群包含多个opc,所述opc是灵长类多潜能干细胞的体外分化后代。一方面,提供了产生细胞群的方法,所述细胞群包含多个opc,所述opc是诱导的多潜能干细胞的体外分化后代。一方面,分化多潜能干细胞的方法包括涉及预处理多个未分化干细胞的一个或多个步骤。一方面,包括一个或多个预处理步骤的方法能够产生包含降低水平的不期望细胞类型的细胞群。一方面,包括一个或多个预处理步骤的方法能够产生包含多个opc的细胞群,所述opc具有少于约15%的不期望的细胞类型。一方面,包括一个或多个预处理步骤的方法能够产生包含多个opc的细胞群,其中所述细胞群能够在根据本发明的囊肿测试中形成小于或等于1个上皮囊肿/100000个细胞。
未分化的多潜能干细胞的繁殖与培养
一方面,可以在多潜能干细胞系上进行方法。另一方面,可以在胚胎干细胞系上进行方法。一方面,可以在衍生自h1,h7,h9,h13或h14细胞系的多个未分化干细胞上进行方法。另一方面,未分化的干细胞可衍生自诱导的多潜能干细胞(ips)系。一方面,可以在灵长类多潜能干细胞(pps)系上进行方法。另一方面,未分化的干细胞可以衍生自孤雌生殖体,其是经刺激以产生hesc而不受精的胚胎。
先前已经描述了未分化的多潜能干细胞的繁殖和培养方法。关于多潜能干细胞的组织和细胞培养,读者可能希望参考本领域可获得的许多出版物中的任何一种,例如,《畸胎癌和胚胎干细胞:实用方法》(teratocarcinomasandembryonicstemcells:apracticalapproach)(e.j.robertson编,irl出版公司(irlpressltd.)1987);《小鼠发育技术指南》(guidetotechniquesinmousedevelopment)(p.m.wasserman等编,学术出版社(academicpress)1993);《胚胎干细胞体外分化》(embryonicstemcelldifferentiationinvitro)(m.v.wiles,meth.enzymol.225:900,1993);胚胎干细胞的性质和用途:应用于人类生物学和基因治疗的前景(propertiesandusesofembryonicstemcells:prospectsforapplicationtohumanbiologyandgenetherapy)(p.d.rathjen等,reprod.fertil.dev.10:31,1998;和r.i.freshney,cultureofanimalcells,纽约约翰威立,2000)。
一方面,未分化的多潜能干细胞可以维持在未分化状态而不添加饲养细胞(参见,例如,(2004)rosler等,dev.dynam.229:259)。无饲养细胞培养物通常由营养培养基支持,所述营养培养基含有促进细胞增殖而不分化的因子(参见例如美国专利号6,800,480)。一方面,可以使用含有这些因子的条件培养基。通过用含有分泌这些因子的细胞对培养基进行培养可以获得条件培养基。合适的细胞包括但不限于经辐射的(约4000ra)原代小鼠胚胎成纤维细胞,端粒化的小鼠成纤维细胞,或衍生自pps细胞的成纤维细胞样细胞(美国专利号6,642,048)。可以通过将饲养细胞铺在无血清培养基中来调节培养基,例如补充有20%血清替代物和4ng/mlbfgf的敲除dmem。已经调节1-2天的培养基可以补充另外的bfgf,并用于支持pps细胞培养1-2天(参见例如wo01/51616;xu等,(2001)nat.biotechnol.19:971)。
或者,可以使用新鲜或非条件培养基,其已经补充了促进未分化形式的细胞增殖的添加因子(如成纤维细胞生长因子或毛喉素)。非限制性实例包括基础培养基,如x-vivotm10(马里兰州沃克斯维尔的隆萨公司(lonza,walkersville,md.))或qbsftm-60(马里兰州盖瑟斯堡的定量生物公司(qualitybiologicalinc.gaithersburg,md.)),补充有40-80ng/ml的bfgf,并且任选地含有scf(15ng/ml)或flt3配体(75ng/ml)(参见,例如,xu等,(2005)stemcells23(3):315)。这些培养基配方具有以在其他系统中的2-3倍速率支持细胞生长的优点(参见例如wo03/020920)。在一个方面,未分化的多潜能细胞如hes细胞可以在包含bfgf和tgfβ的培养基中培养。bfgf的非限制性实例浓度包括约80ng/ml。tgfβ的非限制性实例浓度包括约0.5ng/ml。
一方面,未分化的多潜能细胞可以在饲养细胞层上培养,所述饲养细胞通常是衍生自胚胎或胎儿组织的成纤维细胞(thomson等,(1998)science282:1145)。一方面,饲养细胞可以源自人或鼠源。人饲养细胞可以从各种人组织中分离,或者可以通过人胚胎干细胞分化成成纤维细胞而衍生(参见例如wo01/51616)。一方面,可以使用的人饲养细胞包括但不限于胎盘成纤维细胞(参见,例如,genbacev等(2005)fertil.steril.83(5):1517),输卵管上皮细胞(参见,例如,richards等(2002)nat.biotechnol.,20:933),包皮成纤维细胞(参见,例如,amit等(2003)biol.reprod.68:2150),和子宫内膜细胞(参见,例如,lee等(2005)biol.reprod.72(1):42)。
各种固体表面可用于培养未分化的多潜能细胞。那些固体表面包括但不限于标准的市售细胞培养板,例如6孔,24孔,96孔或144孔板。其他固体表面包括但不限于微载体和圆盘。适于生长未分化的多潜能细胞的固体表面可由多种物质制成,包括但不限于玻璃或塑料,例如聚苯乙烯,聚氯乙烯,聚碳酸酯,聚四氟乙烯,melinex,thermanox或其组合。一方面,合适的表面可包含一种或多种聚合物,例如一种或多种丙烯酸酯。一方面,固体表面可以是三维形状。三维固体表面的非限制性实例描述于例如美国专利公开号2005/0031598。
一方面,未分化的干细胞可以在生长基质上在无饲养细胞条件下生长。在一个方面,生长基质可以是
根据主题方法的一个方面,可以使用多种合适的细胞培养和传代培养技术中的任何一种来培养细胞。例如,一方面,培养基可以以合适的时间间隔更换。一方面,培养基可以每天完全更换,在细胞的传代培养后约2天开始。一方面,当培养物达到约90%的菌落覆盖率时,可以连续使用一种或多种合适的试剂(例如,胶原酶iv和0.05%胰蛋白酶-edta)抛弃并计数替代烧瓶以实现单细胞悬浮液,用于定量。一方面,然后可以将多个未分化的干细胞进行传代培养,然后在合适的生长基质(例如
一方面,接种密度可以为约6.0×103个细胞/cm2至约5.0×105个细胞/cm2,例如约1.0×104个细胞/cm2,例如约5.0×104个细胞/cm2,例如约1.0×105个细胞/cm2,或例如约3.0×105个细胞/cm2生长表面。另一方面,接种密度可以为约6.0×103个细胞/cm2至约1.0×104个细胞/cm2生长表面,例如约6.0×103个细胞/cm2至约9.0×103个细胞/cm2,例如约7.0×103个细胞/cm2至约1.0×104个细胞/cm2,例如约7.0×103个细胞/cm2至约9.0×103个细胞/cm2,或例如约7.0×103个细胞/cm2至约8.0×103个细胞/cm2生长表面。另一方面,接种密度可以为约1.0×104个细胞/cm2至约1.0×105个细胞/cm2生长表面,例如约2.0×104个细胞/cm2至约9.0×104个细胞/cm2,例如约3.0×104个细胞/cm2至约8.0×104个细胞/cm2,例如约4.0×104个细胞/cm2至约7.0×104个细胞/cm2,或例如约5.0×104个细胞/cm2至约6.0×104个细胞/cm2的生长表面。另一方面,接种密度可以为约1.0×105个细胞/cm2至约5.0×105个细胞/cm2生长表面,例如约1.0×105个细胞/cm2至约4.5×105个细胞/cm2,例如约1.5×105个细胞/cm2至约4.0×105个细胞/cm2,例如约2.0×105个细胞/cm2至约3.5×105个细胞/cm2,或例如约2.5×105个细胞/cm2至约3.0×105个细胞/cm2生长表面。
未分化的多潜能干细胞的预处理
另一方面,提供了一种方法,其包括在分化之前预处理未分化的干细胞。不受任何特定理论的束缚,本发明人已经确定了各种预处理步骤,其可以促进多潜能干细胞的自发分化的进一步减少,从而进一步改进不涉及预处理步骤的分化方法。一方面,涉及本文所述的一个或多个预处理步骤的方法可以产生包含低水平的不期望的滋养层细胞谱系细胞的细胞群。另一方面,涉及本文所述的一个或多个预处理步骤的方法可以产生包含低水平的不期望的上皮谱系细胞的细胞群。此外,本发明人已经鉴定了各种预处理步骤,其可以促进在根据本公开的囊肿试验中形成少于或等于1个上皮囊肿/100000个细胞的细胞群的产生。本文详细描述了预处理步骤。
一方面,方法包括用一种或多种干细胞分化调节分子孵育扩增但未分化的干细胞一段时间。一方面,干细胞分化调节分子可以是驱动后续细胞分化远离上皮谱系的分子。不受理论束缚,发明人已经确定将干细胞与一种或多种干细胞分化调节分子一起孵育可以导致上皮谱系细胞的减少。一方面,方法包括用以下四种类型的干细胞分化调节分子中的一种或多种孵育扩增但未分化的干细胞一段时间:(1)alk5的抑制剂,其是smad/tgfβ-rii信号传导通路的一部分;(2)alk2的抑制剂,它是bmpri信号传导通路的一部分;(3)用于激活wnt信号传导途径的gsk3抑制剂;和(4)用于激活shh途径的smoothened激动剂。
一方面,方法包括用一种或多种干细胞分化调节分子孵育扩增但未分化的干细胞一段时间。一方面,干细胞分化调节剂可以是小分子。在一个方面,小分子干细胞分化调节剂是alk5,alk2或gsk3的抑制剂,或者是smoothened激动剂。一方面,alk5抑制剂可选自sb431542,ly364947,repsox及其衍生物。另一方面,alk2抑制剂可选自背吗啡,ldn193189,头蛋白及其衍生物。另一方面,gsk3抑制剂可选自chir99021,6-溴靛玉红-3′-肟(bio),肯帕罗酮,sb216762,wnt蛋白及其衍生物。一方面,smoothened激动剂可选自嘌呤胺,sag(cas364590-63-6),ssh蛋白及其衍生物。一方面,方法包括用以下四种小分子孵育扩增但未分化的干细胞一段时间:sb431542,背吗啡,chir99021和嘌呤胺。sb431542,背吗啡,chir99021和嘌呤胺的化学结构分别描述于图1至图4。
一方面,方法包括用一种或多种干细胞分化调节剂孵育扩增但未分化的干细胞一段时间,如本文所述。一方面,方法包括用两种或多种干细胞分化调节剂孵育扩增但未分化的干细胞一段时间。一方面,方法包括用三种或多种干细胞分化调节剂孵育扩增但未分化的干细胞一段时间。一方面,方法包括用四种或多种干细胞分化调节剂孵育扩增但未分化的干细胞一段时间。一方面,孵育期可以是约一天至约十天,例如约两天,例如约三天,例如约四天,例如约五天,例如约六天,例如约七天,例如约八天,或例如约九天。一方面,孵育期可以为约1天至约5天,例如约1天至约3天,或例如约2天至约5天。另一方面,孵育期可以为约6天至约10天,例如约6天至约8天,或例如约7天至约10天。另一方面,孵育期可以为约3天至约8天,例如约3天至约5天,例如约4天至约6天,例如约5天至约7天,或例如约6天至约8天。
在一个方面,一种方法包括将一群扩增但未分化的干细胞与两种或更多种第一干细胞分化调节剂一起孵育第一孵育期,并将所述群与两种或更多种第二干细胞分化调节剂一起孵育第二孵育期。一方面,第一孵育期可以为约1天至约7天,例如约2天,例如约3天,例如约4天,例如约5天,或例如约6天。一方面,第二孵育期可以为约1天至约7天,例如约2天,例如约3天,例如约4天,例如约5天,或例如约6天。
一方面,两种或更多种第一干细胞分化调节剂不同于两种或更多种第二干细胞分化调节剂。一方面,两种或更多种第一干细胞调节剂与两种或更多种第二干细胞调节剂相同。一方面,第一和第二干细胞调节剂共有至少一个共同调节剂。一方面,第一和第二干细胞调节剂共有两个或更多个共同调节剂,例如三个或更多个共同调节剂,例如四个或更多个共同调节剂。
一方面,方法包括用一种或多种以下分化调节剂孵育扩增但未分化的干细胞约1至10天:sb431542,背吗啡,chir99021和嘌呤胺。一方面,方法包括用sb431542,背吗啡,chir99021和嘌呤胺孵育扩增但未分化的干细胞约1至5天,然后用chir99021和嘌呤胺孵育约1至5天。
一方面,方法包括用sb431542,背吗啡,chir99021和嘌呤胺孵育扩增但未分化的干细胞约4天,然后用chir99021和嘌呤胺孵育3天。
一方面,一种方法包括将扩增但未分化的esc与sb431542一起孵育,sb431542浓度范围为约1μm至约100μm,例如约5μm,约10μm,例如约15μm,例如约20μm,例如约25μm,例如约30μm,例如约35μm,例如约40μm,例如约45μm,例如约50μm,例如约55μm,例如约60μm,例如约65μm,例如约70μm,例如约75μm,例如约80μm,例如约85μm,例如约90μm,或例如约95μm。另一方面,一种方法包括将扩增但未分化的esc与sb431542一起孵育,sb431542浓度范围为约1μm至约20μm,例如约1μm至约13μm,例如约8μm至约20μm,例如约8μm至约13μm,或例如约9μm至约11μm。另一方面,一种方法包括将扩增但未分化的esc与sb431542一起孵育,sb431542浓度范围为约20μm至约40μm,例如约20μm至约33μm,例如约28μm至约40μm,例如约28μm至约33μm,或例如约29μm至约31μm。一方面,一种方法包括将扩增但未分化的esc与sb431542一起孵育,sb431542浓度范围为约40μm至约60μm,例如约40μm至约53μm,例如约48μm至约55μm,例如约48μm至约53μm,或例如约49μm至约51μm。一方面,一种方法包括将扩增但未分化的esc与sb431542一起孵育,sb431542浓度范围为约60μm至约80μm,例如约60μm至约73μm,例如约68μm至约75μm,例如约68μm至约73μm,或例如约69μm至约71μm。一方面,一种方法包括将扩增但未分化的esc与sb431542一起孵育,sb431542浓度范围为约80μm至约100μm,例如约80μm至约93μm,例如约88μm至约95μm,例如约88μm至约93μm,或例如约89μm至约91μm。一方面,一种方法包括将扩增但未分化的esc与sb431542以约10μm的浓度孵育。
一方面,一种方法包括将扩增但未分化的esc与alk5抑制剂一起孵育,所述alk5抑制剂的浓度范围为约250nm至约250μm,例如约1μm,约10μm,约50μm,约100μm,约150μm,或约200μm。一方面,一种方法包括将扩增但未分化的esc与ly364947一起孵育,ly364947浓度范围为约250μm至约25μm,例如约250μm至约1μm,例如约1μm至约10μm,或例如约10μm至约25μm。一方面,一种方法包括将扩增但未分化的esc与约2.5μm的ly364947孵育。另一方面,一种方法包括将扩增但未分化的esc与repsox一起孵育,repsox浓度范围为约2.5μm至约250μm,例如约2.5μm至约10μm,例如约10μm至约100μm,或例如约100μm至约250μm。一方面,一种方法包括将扩增但未分化的esc与约25μm的repsox孵育。
一方面,一种方法包括将扩增但未分化的esc与背吗啡一起孵育,背吗啡浓度范围为约0.2μm至约20μm,例如约0.5μm,例如约0.8μm,例如约1μm,例如约1.5μm,例如约2μm,例如约2.5μm,例如约3μm,例如约3.5μm,例如约4μm,例如约4.5μm,例如约5μm,例如约5.5μm,例如约6μm,例如约6.5μm,例如约7μm,例如约7.5μm,例如约8μm,例如约8.5μm,例如约9μm,例如约10μm,例如约11μm,例如约12μm,例如约13μm,例如约14μm,例如约15μm,例如约16μm,例如约17μm,例如约18μm,或例如约19μm。另一方面,一种方法包括将扩增但未分化的esc与背吗啡一起孵育,背吗啡浓度范围为约0.2μm至约1μm,例如约0.2μm至约0.9μm,例如约0.3μm至约0.8μm,例如约0.4μm至约0.7μm,或例如约0.5μm至约0.6μm。另一方面,一种方法包括将扩增但未分化的esc与背吗啡一起孵育,背吗啡浓度范围为约1μm至约10μm,例如约1μm至约9μm,例如约2μm至约8μm,例如约3um至约7μm,或例如约4μm至约6μm。一方面,一种方法包括将扩增但未分化的esc与背吗啡一起孵育,背吗啡浓度范围为约10μm至约20μm,例如约10μm至约19μm,例如约12μm至约18μm,例如约13μm至约17μm,或例如约14μm至约16μm。一方面,一种方法包括将扩增但未分化的esc与背吗啡以约2μm的浓度孵育。
一方面,一种方法包括将扩增但未分化的esc与alk2抑制剂一起孵育,所述alk2抑制剂的浓度范围为约1nm至约20μm,例如约10nm,约50nm,约100nm,约150nm,约200nm,约500nm,约1μm,约5μm,约10μm,或约15μm。一方面,一种方法包括将扩增但未分化的esc与ldn193189一起孵育,ldn193189浓度范围为约lnm至约100nm,例如约lnm至约10nm,例如约10nm至约50nm,或例如约50nm至约100nm。一方面,一种方法包括将扩增但未分化的esc与约10nm的ldn193189孵育。一方面,一种方法包括将扩增但未分化的esc与头蛋白一起孵育,头蛋白浓度范围为约2nm至约200nm,例如约2nm至约10nm,例如约10nm至约100nm,或例如约100nm至约200nm。一方面,一种方法包括将扩增但未分化的esc与约20nm的头蛋白孵育。
一方面,一种方法包括将扩增但未分化的esc与chir99021一起孵育,chir99021浓度范围为约0.3μm至约30μm,例如约0.5μm,例如约0.8μm,例如约1μm,例如约1.5μm,例如约2μm,例如约2.5μm,例如约3μm,例如约3.5μm,例如约4μm,例如约4.5μm,例如约5μm,例如约5.5μm,例如约6μm,例如约6.5μm,例如约7μm,例如约7.5μm,例如约8μm,例如约8.5μm,例如约9μm,例如约10μm,例如约11μm,例如约12μm,例如约13μm,例如约14μm,例如约15μm,例如约20μm,或例如约25μm。另一方面,一种方法包括将扩增但未分化的esc与chir99021一起孵育,chir99021浓度范围为约0.3μm至约1μm,例如约0.3μm至约0.9μm,例如约0.4μm至约0.8μm,或例如约0.5μm至约0.7μm。另一方面,一种方法包括将扩增但未分化的esc与chir99021一起孵育,chir99021浓度范围为约1μm至约10μm,例如约1μm至约9μm,例如约2μm至约8μm,例如约3μm至约7μm,或例如约4μm至约6μm。一方面,一种方法包括将扩增但未分化的esc与chir99021一起孵育,chir99021浓度范围为约10μm至约20μm,例如约11μm至约19μm,例如约12μm至约18μm,例如约13μm至约17μm,或例如约14μm至约16μm。一方面,一种方法包括将扩增但未分化的esc与chir99021一起孵育,chir99021浓度范围为约20μm至约30μm,例如约21μm至约29μm,例如约22μm至约28μm,例如约23μm至约27μm,或例如约24μm至约26μm。一方面,一种方法包括将扩增但未分化的esc与约3μm浓度的chir99021孵育。
一方面,一种方法包括将扩增但未分化的esc与gsk3抑制剂一起孵育,所述gsk3抑制剂的浓度范围为约25nm至约100μm,例如约100nm,约250nm,约500nm,约750nm,约1μm,约10μm,或约50μm。一方面,一种方法包括将扩增但未分化的esc与bio(6-溴靛玉红-3′-肟)一起孵育,bio(6-溴靛玉红-3′-肟)的浓度范围为约500μm至约50μm,例如约500μm至约1μm,例如约1μm至约10μm,或例如约10μm至约50μm。一方面,方法包括将扩增但未分化的esc与约5μm的bio(6-溴靛玉红-3′-肟)一起孵育。另一方面,一种方法包括将扩增但未分化的esc与肯帕罗酮一起孵育,肯帕罗酮浓度范围为约1μm至约100μm,例如约1μm至约10μm,例如约10μm至约50μm,或例如约50μm至约100μm。一方面,一种方法包括将扩增但未分化的esc与约10μm的肯帕罗酮孵育。另一方面,一种方法包括将扩增但未分化的escsb216763一起孵育,escsb216763浓度范围为约500μm至约50μm,例如约500μm至约1μm,例如约1μm至约10μm,或例如约10μm至约50μm。一方面,一种方法包括将扩增但未分化的esc与约5μm的sb216763孵育。另一方面,一种方法包括将扩增但未分化的esc与wnt蛋白一起孵育,wnt蛋白浓度范围为约25nm至约2.5μm,例如约25nm至约100nm,例如约100nm至约1μm,或例如约1μm至约2.5μm。一方面,一种方法包括将扩增但未分化的esc与约250nm的wnt蛋白孵育。
一方面,方法包括将扩增但未分化的esc与嘌呤胺一起孵育,嘌呤胺浓度范围为约0.05μm至约5μm,例如约0.08μm,例如约0.1μm,例如约0.2μm,例如约0.3μm,例如约0.4μm,例如约0.5μm,例如约0.6μm,例如约0.7μm,例如约0.8μm,例如约0.9μm,例如约1μm,例如约2μm,例如约3μm,例如约4μm。另一方面,一种方法包括将扩增但未分化的esc与嘌呤胺一起孵育,嘌呤胺浓度范围为约0.05μm至约0.1μm,例如约0.06μm至约0.09μm,或例如约0.07μm至约0.08μm。另一方面,一种方法包括将扩增但未分化的esc与嘌呤胺一起孵育,嘌呤胺浓度范围为约0.1μm至约1μm,例如约0.2μm至约0.9μm,例如约0.3μm至约0.8μm,例如约0.4μm至约0.7μm,或例如约0.5μm至约0.6μm。另一方面,一种方法包括将扩增但未分化的esc与嘌呤胺一起孵育,嘌呤胺浓度范围为约1μm至约5μm,例如约1μm至约4μm,例如约2μm至约5μm,或例如约2μm至约4μm。一方面,一种方法包括将扩增但未分化的esc与约0.5μm浓度的嘌呤胺孵育。
一方面,一种方法包括将扩增但未分化的esc与smoothened激动剂一起孵育,所述smoothened激动剂的浓度范围为约2.5nm至约5μm,例如约50nm,约100nm,约250nm,约500nm,约750nm,约1μm,或约2.5μm。一方面,一种方法包括将扩增但未分化的esc与sag一起孵育,sag浓度范围为约10nm至约1μm,例如约10nm至约100nm,例如约100nm至约500nm,或例如约500nm至约1000nm。一方面,一种方法包括将扩增但未分化的esc与约100nm的sag孵育。一方面,一种方法包括将扩增但未分化的esc与shh蛋白一起孵育,shh蛋白浓度范围为约2.5nm至约250nm,例如约2.5nm至约10nm,例如约10nm至约100nm,或例如约100nm至约250nm。一方面,一种方法包括将扩增但未分化的esc与约25nm的shh蛋白孵育。
一方面,未分化的干细胞可以在生长基质上扩增以准备预处理。生长基质的非限制性示例包括
一方面,可以通过使用串联使用胶原酶iv和0.05%胰蛋白酶-edta的替代烧瓶计数细胞来启动未分化干细胞在有或没有预处理的情况下的分化,以获得用于定量的单细胞悬浮液并采用胶原酶iv和手动刮擦收获剩余未分化的干细胞培养物。一方面,可以将未分化的干细胞培养物接种到超低附着(ula)容器中以形成密度为约1×105个细胞/cm2至约14×105个细胞/cm2,例如约2×105个细胞/cm2至约13×105个细胞/cm2,例如约3×105个细胞/cm2至约12×105个细胞/cm2,例如约4×105个细胞/cm2至约11×105个细胞/cm2,例如约5×105个细胞/cm2至约10×105个细胞/cm2,例如约6×105个细胞/cm2至约9×105个细胞/cm2,例如约7×105个细胞/cm2至约8×105个细胞/cm2的胚状体(eb)。一方面,未分化的干细胞以约8×105个细胞/cm2接种。
在一个方面,在分化的第二天,可以使用x-vivo10和胶质祖细胞培养基(gpm)的1∶1混合物进行完全培养基交换,其由dmem/f12(吉布可目录号10565-018),2%b27补充剂(吉布可目录号17504-044),0.04μg三碘-甲状腺素(西格玛目录号t5516-1mg),补充有4ng/mlhbfgf和20ng/mlegf(生命技术目录号phg0311)组成。一方面,gpm可以补充有hbfgf,egf和视黄酸(ra)。一方面,从分化的第二天开始,培养基可以是仅用egf和ra补充的100%gpm。一方面,每天更换该培养基直至第9天。一方面,从第9天至第27天,每隔一天更换补充有egf的gpm培养基。一方面,在第27天,在分化开始时,将eb以约2cm2/1cm2接种的ula的比例接种到涂覆的容器上。一方面,涂覆的容器可以涂覆有
opc组合物
如上所述,本公开的一个方面包括包含多个少突胶质细胞祖细胞(opc)的组合物,以及其制备方法和用于改善需要治疗的对象的一种或多种神经功能的方法。在某些方面,多个opc是灵长类多潜能干(pps)细胞的体外分化后代。在某些方面,多个opc是人胚胎干细胞的体外分化后代。在其他方面,多个opc是诱导的多潜能干(ips)细胞的体外分化后代。一方面,提供了包含细胞群的组合物,所述细胞群包含多个opc和低水平的不期望的细胞类型。
一方面,细胞群可具有共同的遗传背景。一方面,细胞群可以源自一个宿主。一方面,细胞群可以源自多潜能干细胞系。另一方面,细胞群可以源自胚胎干细胞系。一方面,细胞群可以源自hesc系。一方面,hesc系可以是h1,h7,h9,h13或h14细胞系。另一方面,细胞群可以源自诱导的多潜能干细胞(ips)系。一方面,细胞群可以源自有此需要的对象(例如,细胞群可以源自需要治疗的对象)。另一方面,hesc系可以衍生自孤雌生殖体,其是经刺激以产生hesc而不受精的胚胎。
一方面,细胞群未经历细胞富集。一方面,细胞群未经历opc的阳性选择。一方面,opc的阳性选择可以是针对巢蛋白,ng2或pdgf-rα的抗体选择,例如,使用流式细胞术或磁珠。一方面,细胞群可能未经历对不期望的细胞类型的阴性选择。一方面,opc的阴性选择可以是针对epcam或cd49f的抗体选择,例如,使用流式细胞术或磁珠。
在一个方面,细胞群的一种或多种特征可以通过使用流式细胞术定量各种细胞标志物来确定,例如,以确定对特定标志物或标志物组呈阳性的细胞群的百分比。一方面,细胞群可包含约30%至约100%的ng2阳性细胞,例如至少约35%,例如至少约40%,例如至少约45%,例如至少约50%,例如至少约55%,例如至少约60%,例如至少约65%,例如至少约70%,例如至少约75%,例如至少约80%,例如至少约85%,例如至少约90%,例如至少约95%,例如至少约98%,例如至少约99%,例如至少约99.5%,例如至少约99.8%,或例如至少约99.9%的ng2阳性细胞。另一方面,细胞群可包含约30%至约60%的ng2阳性细胞,例如约30%至约35%,例如约35%至约40%,例如约40%至约45%,例如约45%至约50%,例如约35%至约55%,例如约40%至50%,或例如约43%至约48%的ng2阳性细胞。另一方面,细胞群可包含约45%至约75%的ng2阳性细胞,例如约45%至约50%,例如约50%至约55%,例如约55%至约60%,例如约60%至约65%,例如约65%至约70%,例如约70%至约75%,例如约50%至约70%,例如约55%至约65%,或例如约58%至约63%的ng2阳性细胞。一方面,细胞群可包含约60%至约90%的ng2阳性细胞,例如约60%至约65%,例如约65%至约70%,例如约75%至约80%。例如约85%至约90%,例如约65%至约85%,例如约70%至约80%,或例如约73%至约78%的ng2阳性细胞。一方面,细胞群可包含约75%至约100%的ng2阳性细胞,例如约75%至约80%,例如约85%至约90%,例如约90%至约95%,例如约95%至约100%,例如约80%至约95%,例如约85%至约90%,或例如约73%至约78%的ng2阳性细胞。一方面,细胞群可包含至少约30%的ng2阳性细胞。另一方面,细胞群可包含至少约40%的ng2阳性细胞。一方面,细胞群可包含至少约50%的ng2阳性细胞。
一方面,细胞群可包含约80%至约100%的巢蛋白阳性细胞,例如至少约85%,例如至少约90%,例如至少约95%,例如约99%。例如至少约99.5%,例如至少约99.8%,或例如至少约99.9%的巢蛋白阳性细胞。另一方面,细胞群可包含约80%至约90%的巢蛋白阳性细胞,例如约80%至约85%,或例如约83%至约88%的巢蛋白阳性细胞。另一方面,细胞群可包含约90%至约100%的巢蛋白阳性细胞,例如约90%至约95%,例如约95%至约98%,例如约98%至约99%,例如约99%至约99.5%,例如约99.5%至约99.8%,例如约99.8%至约99.9%,例如约99.9%至约100%,例如约90%至约99.9%,例如约95%至约99.8%,或例如约98%至约99.5%的巢蛋白阳性细胞。一方面,细胞群可包含至少约99%的巢蛋白阳性细胞。
一方面,细胞群可包含约80%至约100%的pdgf-rα阳性细胞,例如至少约85%,例如至少约90%,例如至少约95%,例如约99%,例如约99.5%,例如约99.9%,或例如至少约100%的pdgf-rα阳性细胞。另一方面,细胞群可包含约80%至约90%的pdgf-rα阳性细胞,例如约80%至约85%,例如约85%至约90%,或例如约83%至约88%的pdgf-rα阳性细胞。另一方面,细胞群可包含约90%至约100%的pdgf-rα阳性细胞,例如约90%至约95%,例如约95%至约98%,例如约98%至约99%,例如约99%至约99.5%,例如约99.5%至约99.8%,例如约99.8%至约99.9%,例如约99.9%至约100%,例如约90%至约99.9%,例如约95%至约99.8%,或例如约98%至约99.5%的pdgf-rα阳性细胞。一方面,细胞群可包含至少约80%的pdgf-rα阳性细胞。
一方面,细胞群可包含约50%的ng2阳性细胞和约81%的pdgf-rα阳性细胞。另一方面,细胞群可包含约50%的ng2阳性细胞,约81%的pdgf-rα阳性细胞,和约99%的巢蛋白阳性细胞。
一方面,至少约90%的细胞群可以表达至少一种选自下组的标志物:巢蛋白,pdgf-rα,nkx2.2,olig1和igf2。另一方面,至少约90%的细胞群可以表达至少2种选自下组的标志物:巢蛋白,pdgf-rα,nkx2.2,olig1和igf2。另一方面,至少约90%的细胞群可以表达至少3种选自下组的标志物:巢蛋白,pdgf-rα,nkx2.2,olig1和igf2。另一方面,至少约90%的细胞群可以表达至少4种选自下组的标志物:巢蛋白,pdgf-rα,nkx2.2,olig1和igf2。一方面,至少约90%的细胞群可以表达巢蛋白,pdgf-rα,nkx2.2,olig1和igf2的全部。一方面,约90%至约100%的细胞群可以表达至少一种选自下组的标志物:巢蛋白,pdgf-rα,nkx2.2,olig1和igf2。一方面,约95%至约100%,例如约98%至约100%,例如约99%至约100%,例如约99.5%至约100%,例如约99.8%至约100%,或例如约99.9%至约100%的细胞群可以表达至少一种选自下组的标志物:巢蛋白,pdgf-rα,nkx2.2,olig1和igf2。
一方面,细胞群能够产生一种或多种生物信号传导因子。一方面,细胞群能够产生一种或多种血管生成信号传导因子。一方面,血管生成信号传导因子可以是血小板反应蛋白-1,丝抑蛋白1,或丝抑蛋白2。一方面,细胞群能够产生一种或多种神经信号传导因子。一方面,神经信号传导因子可以是ngf,导蛋白4,肌腱蛋白c,血小板反应蛋白1,血小板反应蛋白3,slit1或slit3。一方面,可以通过elisa检测神经信号传导因子。在一个方面,生物信号传导因子可以是胶质衍生的导蛋白1,基膜聚糖,timp2,igf2,mmp15或vegf。一方面,生物信号传导因子可以是核心蛋白聚糖。一方面,生物信号传导因子可以是中期因子。
一方面,生物信号传导因子可以由包含以大于约50pg/ml,例如大于约100pg/ml,例如大于约200pg/ml,例如大于约300pg/ml,例如大于约400pg/ml,例如大于约500pg/ml,例如大于约1,000pg/ml,例如大于约2,000pg/ml,例如大于约3,000pg/ml,例如大于约4,000pg/ml,例如大于约5,000pg/ml,例如大于约6,000pg/ml,或例如大于约7,000pg/ml的浓度包含opc的细胞群的组合物分泌。一方面,生物信号传导因子可以由包含以浓度范围为约50pg/ml至约100,000p/ml,例如约100pg/ml,例如约150pg/ml,例如约200pg/ml,例如约250pg/ml,例如约300pg/ml,例如约350pg/ml,例如约400pg/ml,例如约450pg/ml,例如约500pg/ml,例如约550pg/ml,例如约600pg/ml,例如约650pg/ml,例如约700pg/ml,例如约750pg/ml,例如约800pg/ml,例如约850pg/ml,例如约900pg/ml,例如约1,000pg/ml,例如约1,500pg/ml,例如约2,000pg/ml,例如约2000pg/ml,例如约2,500pg/ml,例如约3,000pg/ml,例如约3,500pg/ml,例如约4,000pg/ml,例如约4,500pg/ml,例如约5,000pg/ml,例如约5,500pg/ml,例如约6,000pg/ml,例如约6,500pg/ml,例如约7,000pg/ml,例如约7,500pg/ml,例如约8,000pg/ml,例如约8,500pg/ml,例如约9,000pg/ml,例如约10,000pg/ml,例如约15,000pg/ml,例如约20,000pg/ml,例如约25,000pg/ml,例如约30,000pg/ml,例如约35,000pg/ml,例如约40,000pg/ml,例如约45,000pg/ml,例如约50,000pg/ml,例如约55,000pg/ml,例如约60,000pg/ml,例如约65,000pg/ml,例如约70,000pg/ml,例如约75,000pg/ml,例如约80,000pg/ml,例如约85,000pg/ml,例如约90,000pg/ml,例如约95,000pg/ml包含opc的细胞群的组合物分泌。一方面,生物信号传导因子可以由包含以浓度范围为约50pg/ml至约1,000pg/ml,例如约50pg/ml至约100pg/ml,例如约100pg/ml至约200pg/ml,例如约200pg/ml至约300pg/ml,例如约300pg/ml至约400pg/ml,例如约400pg/ml至约500pg/ml,例如约500pg/ml至约600pg/ml,例如约600pg/ml至约700pg/ml,例如约700pg/ml至约800pg/ml,例如约800pg/ml至约900pg/ml,或例如约900pg/ml至约1,000pg/ml包含opc的细胞群的组合物分泌。一方面,生物信号传导因子可以由包含以浓度范围为约1,000pg/ml至约10,000pg/ml,例如约1,000pg/ml至约2,000pg/ml,例如约2,000pg/ml至约3,000pg/ml,例如约3,000pg/ml至约4,000pg/ml,例如约4,000pg/ml至约5,000pg/ml,例如约5,000pg/ml至约6,000pg/ml,例如约6,000pg/ml至约7,000pg/ml,例如约7,000pg/ml至约8,000pg/ml,例如约8,000pg/ml至约9,000pg/ml,或例如约9,000pg/ml至约10,000pg/ml包含opc的细胞群的组合物分泌。一方面,生物信号传导因子可以由包含以浓度范围为约10,000pg/ml至约100,000pg/ml,例如约10,000pg/ml至约20,000pg/ml,例如约20,000pg/ml至约30,000pg/ml,例如约30,000pg/ml至约40,000pg/ml,例如约40,000pg/ml至约50,000pg/ml,例如约50,000pg/ml至约60,000pg/ml,例如约60,000pg/ml至约70,000pg/ml,例如约70,000pg/ml至约80,000pg/ml,例如约80,000pg/ml至约90,000pg/ml,或例如约90,000pg/ml至约100,000pg/ml包含opc的细胞群的组合物分泌。
一方面,中期因子可以由包含以浓度范围为约100pg/ml至约10,000pg/ml包含opc的细胞群的组合物分泌。另一方面,核心蛋白聚糖可以由包含以浓度范围为约500pg/ml至约50,000pg/ml包含opc的细胞群的组合物分泌。另一方面,导蛋白4可以由包含以浓度范围为约500pg/ml至约50,000pg/ml包含opc的细胞群的组合物分泌。一方面,胶质衍生的导蛋白1可以由包含以浓度范围为约500pg/ml至约50,000pg/ml包含opc的细胞群的组合物分泌。一方面,基膜聚糖可以由包含以浓度范围为约500pg/ml至约50,000pg/ml包含opc的细胞群的组合物分泌。一方面,timp2可以由包含以浓度范围为约500pg/ml至约50,000pg/ml包含opc的细胞群的组合物分泌。一方面,igf2可以由包含以浓度范围为约100pg/ml至约10,000pg/ml包含opc的细胞群的组合物分泌。一方面,mmp15可以由包含以浓度范围为约50pg/ml至约5,000pg/ml包含opc的细胞群的组合物分泌。一方面,vegf可以由包含以浓度范围为约50pg/ml至约5,000pg/ml包含opc的细胞群的组合物分泌。一方面,ngf可以由包含以浓度范围为约50pg/ml至约5,000pg/ml包含opc的细胞群的组合物分泌。
一方面,如本公开的实施例5中所述,细胞群能够在囊肿试验中形成少于或等于1个上皮囊肿/100,000个细胞。一方面,如本公开的实施例5中所述,细胞群能够在囊肿试验中每约200,000个细胞,每约300,000个细胞,每约400,000个细胞或每约500,000个细胞形成少于或等于1个上皮囊肿。
不期望的细胞类型
一方面,细胞群可包含少于约20%的不期望的细胞类型,例如少于约19%,例如少于约18%,例如少于约17%,例如少于约16%,例如少于约15%,例如少于约14%,例如少于约13%,例如少于约12%,例如少于约11%,例如少于约10%,例如少于约9%,例如少于约8%,例如少于约7%,例如少于约6%,例如少于约5%,例如少于约4%,例如少于约3%,例如少于约2%,例如少于约1%,例如少于约0.5%,例如少于约0.1%,例如少于约0.05%,或例如少于约0.01%的不期望的细胞类型。另一方面,细胞群可包含约15%至约20%的不期望的细胞类型,例如约19%至约20%,例如约18%至约20%,例如约17%至约20%。例如约16%至约20%,例如约15%至约19%,或例如约16%至约18%的不期望的细胞类型。另一方面,细胞群可包含约10%至约15%的不期望的细胞类型,例如约14%至约15%,例如约13%至约15%,例如约12%至约15%,例如约11%至约15%,或例如约12%至约14%的不期望的细胞类型。一方面,细胞群可包含约1%至约10%的不期望的细胞类型,例如约2%至约10%,例如约1%至约9%,例如约2%至约8%。例如约3%至约7%,或例如约4%至约6%的不期望的细胞类型。一方面,细胞群可包含约0.1%至约1%的不期望的细胞类型,例如约0.2%至约1%,例如约0.1%至约0.9%,例如约0.2%至约0.8%。例如约0.3%至约0.7%,或例如约0.4%至约0.6%的不期望的细胞类型。一方面,细胞群可包含约0.01%至约0.1%的不期望的细胞类型,例如约0.02%至约0.1%,例如约0.01%至约0.09%,例如约0.02%至约0.08%,例如约0.03%至约0.07%,或例如约0.04%至约0.06%的不期望的细胞类型。一方面,低水平的不期望的细胞类型可以表示存在少于约15%的不期望的细胞类型。
一方面,不期望的细胞类型可包括上皮谱系细胞。一方面,上皮谱系细胞的特征在于存在k7或pck之一。一方面,上皮谱系细胞的特征在于存在k7和pck。
一方面,不期望的细胞类型可包括k7阳性细胞。一方面,细胞群可包含小于约5%的k7阳性细胞,例如小于约4%,例如小于约3%,例如小于约2%,例如小于约1.5%,例如小于约1%,例如小于约0.9%,例如小于约0.8%,例如小于约0.7%,例如小于约0.6%,例如小于约0.5%,例如小于约0.4%,例如小于约0.3%,例如小于约0.2%,例如小于约0.1%,例如小于约0.09%,例如小于约0.08%,例如小于约0.07%,例如小于约0.06%,例如小于约0.05%,或例如小于约0.01%的k7阳性细胞。一方面,细胞群可包含约0.01%至约5%的k7阳性细胞,例如约0.05%,例如约0.1%,例如约0.2%,例如约0.3%,例如约0.4%,例如约0.5%,例如约0.6%,例如约0.7%,例如约0.8%,例如约0.9%,例如约1%,例如约1.5%,例如约2%,例如约2.5%,例如约3%,例如约3.5%,例如约4%,或例如约4.5%的k7阳性细胞。一方面,细胞群可包含约1%至约5%的k7阳性细胞,例如约2%至约4%,例如约1%至约3%,或例如约3%至约5%的k7阳性细胞。一方面,细胞群可包含约0.1%至约1%,例如约0.2%至约0.9%,例如约0.3%至约0.8%,例如约0.4%至约0.7%,或例如约0.5%至约0.6%的k7阳性细胞。一方面,细胞群可包含约0.01%至约0.1%的k7阳性细胞,例如约0.02%至约0.09%,例如约0.03%至约0.08%,例如约0.04%至约0.07%,或例如约0.05%至约0.06%的k7阳性细胞。一方面,细胞群可包含少于约2%的k7阳性细胞。另一方面,细胞群可包含少于约0.2%的k7阳性细胞。
一方面,不期望的细胞类型可包括pck阳性细胞。一方面,细胞群可包含小于约10%的pck阳性细胞,例如小于约9%,例如小于约8%,例如小于约7%,例如小于约6%,例如小于约5%,例如小于约4.5%,例如小于约4%,例如小于约3.5%,例如小于约3%,例如小于约2.5%,例如小于约2%,例如小于约1.5%,例如小于约1%,例如小于约0.5%,例如小于约0.1%,例如小于约0.05%,或例如小于约0.01%的pck阳性细胞。一方面,细胞群可包含约0.01%至约10%的pck阳性细胞,例如约0.05%,例如约0.1%,例如约0.2%,例如约0.3%,例如约0.4%,例如约0.5%,例如约0.6%,例如约0.7%,例如约0.8%,例如约0.9%,例如约1%,例如约2%,例如约3%,例如约4%,例如约5%,例如约6%,例如约7%,例如约8%,或例如约9%的pck阳性细胞。一方面,细胞群可包含约1%至约10%的pck阳性细胞,例如约2%至约9%,例如约3%至约8%,例如约4%至约7%,或者例如约5%至约6%的pck阳性细胞。一方面,细胞群可包含约0.1%至约1%的pck阳性细胞,例如约0.2%至约0.9%,例如约0.3%至约0.8%,例如约0.4%至约0.7%,或例如约0.5%至约0.6%的pck阳性细胞。一方面,细胞群可包含约0.01%至约0.1%的pck阳性细胞,例如约0.02%至约0.09%,例如约0.03%至约0.08%,例如约0.04%至约0.07%,或例如约0.05%至约0.06%的pck阳性细胞。一方面,细胞群可包含少于约5%的pck阳性细胞。
一方面,opc群可包含约2%的k7阳性细胞和约4%的pck阳性细胞。
制剂
一方面,根据本公开的组合物可以进一步包含药学上可接受的运载体。一方面,药学上可接受的运载体可包含二甲亚砜(dmso)。一方面,药学上可接受的运载体不包含二甲亚砜。一方面,组合物可以适于冷冻保存。
一方面,可以配制根据本发明的组合物,用于通过直接注射到对象的脊髓来给予。一方面,根据本发明的组合物可以配制用于对对象进行脑内,心室内,鞘内,鼻内或脑池内给药。一方面,可以配制根据本发明的组合物,用于通过注射直接进入对象脑中的梗塞腔或紧邻对象脑中的梗塞腔进行给药。一方面,可以配制根据本公开的组合物用于通过植入给药。一方面,可以将根据本公开的组合物配制成溶液。
一方面,根据本公开的组合物可包含约1×106至约5×108个细胞/毫升,例如约1×106个细胞/毫升,例如约2×106个细胞/毫升,例如约3×106个细胞/毫升,例如约4×106个细胞/毫升,例如约5×106个细胞/毫升,例如约6×106个细胞/毫升,例如约7×106个细胞/毫升,例如约8×106个细胞/毫升,例如约9×106个细胞/毫升,例如约1×107个细胞/毫升,例如约2×107个细胞/毫升,例如约3×107个细胞/毫升,例如约4×107个细胞/毫升,例如约5×107个细胞/毫升,例如约6×107个细胞/毫升,例如约7×107个细胞/毫升,例如约8×107个细胞/毫升,例如约9×107个细胞/毫升,例如约1×108个细胞/毫升,例如约2×108个细胞/毫升,例如约3×108个细胞/毫升,例如约4×108个细胞/毫升,或例如约5×108个细胞/毫升。另一方面,根据本公开的组合物可包含约1×108至约5×108个细胞/毫升,例如约1×108至约4×108个细胞/毫升,例如约2×108个细胞至约5×108个细胞/毫升,例如约1×108至约3×108个细胞/毫升,例如约2×108至约4×108个细胞/毫升,或例如约3×108至约5×108个细胞/毫升。另一方面,根据本发明的组合物可包含约1×107至约1×108个细胞/毫升,例如约2×107至约9×107个细胞/毫升,例如约3×107至约8×107个细胞/毫升,例如约4×107至约7×107个细胞/毫升,或例如约5×107至约6×107个细胞/毫升。一方面,根据本发明的组合物可包含约1×106至约1×107个细胞/毫升,例如约2×106至约9×106个细胞/毫升,例如约3×106个细胞至约8×106个细胞/毫升,例如约4×106至约7×106个细胞/毫升,或例如约5×106至约6×106个细胞/毫升。另一方面,根据本发明的组合物可包含至少约1×106个细胞/毫升,例如至少约2×106个细胞/毫升,例如至少约3×106个细胞/毫升,例如至少约4×106个细胞/毫升,例如至少约5×106个细胞/毫升,例如至少约6×106个细胞/毫升,例如至少约7×106个细胞/毫升,例如至少约8×106个细胞/毫升,例如至少约9×106个细胞/毫升,例如至少约1×107个细胞/毫升,例如至少约2×107个细胞/毫升,例如至少约3×107个细胞/毫升,例如至少约4×107个细胞/毫升,或例如至少约5×107个细胞/毫升。一方面,根据本公开的组合物可包含至多约1×108个细胞或更多,例如至多约2×108个细胞/毫升或更多,例如至多约3×108个细胞/毫升或更多,例如至多约4×108个细胞/毫升或更多,例如至多约5×108个细胞/毫升或更多,或例如至多约6×108个细胞/毫升。
一方面,根据本公开的组合物可包含约4×107至约2×108个细胞/毫升。
另一方面,根据本发明的组合物可具有约10微升至约5毫升,例如约20微升,例如约30微升,例如约40微升,例如约50微升,例如约60微升,例如约70微升,例如约80微升,例如约90微升,例如约100微升,例如约200微升,例如约300微升,例如约400微升,例如约500微升,例如约600微升,例如约700微升,例如约800微升,例如约900微升,例如约1毫升,例如约1.5毫升,例如约2毫升,例如约2.5毫升,例如约3毫升,例如约3.5毫升,例如约4毫升,或例如约4.5毫升的体积。一方面,根据本公开的组合物可具有约10微升至约100微升,例如约20微升至约90微升,例如约30微升至约80微升,例如约40微升至约70微升,或例如约50微升至约60微升的体积。另一方面,根据本发明的组合物可具有约100微升至约1毫升,例如约200微升至约900微升,例如约300微升至约800微升,例如约400微升至约700微升,或例如约500微升至约600微升的体积。另一方面,根据本发明的组合物可具有约1毫升至约5毫升,例如约2毫升至约5毫升,例如约1毫升至约4毫升,例如约1毫升至约3毫升,例如约2毫升至约4毫升,或例如约3毫升至约5毫升的体积。一方面,根据本公开的组合物可具有约20微升至约500微升的体积。另一方面,根据本公开的组合物可具有约50微升至约100微升的体积。另一方面,根据本公开的组合物可具有约50微升至约200微升的体积。另一方面,根据本公开的组合物可具有约20微升至约400微升的体积。
容器
一方面,容器可包含含有根据本发明的细胞群的组合物。一方面,容器可以配置用于冷冻保存。一方面,容器可以被配置用于向有需要的对象给药。一方面,容器可以是预填充注射器。
使用方法
本公开的一个方面包括使用细胞群的方法,所述细胞群包含如本文所述的多个opc,用于改善需要治疗的对象中的一种或多种神经功能。一方面,可以将根据本公开的细胞群注射或植入有需要的对象中。一方面,对象可能需要中枢神经系统的功能改善。一方面,可以将根据本公开的细胞群注射或植入有需要的对象中以治疗脊髓损伤,中风或多发性硬化。
一方面,根据本公开的细胞群能够在将高达约1×109个细胞植入中枢神经系统损伤部位时,在少于约2%的对象中产生异位组织,所述细胞例如高达约1×106个细胞,例如高达约25×106个细胞,例如高达约50×106个细胞,例如高达约75×106个细胞,例如高达约100×106个细胞,例如高达约200×106个细胞,例如高达约300×106个细胞,例如高达约400×106个细胞,例如高达约500×106个细胞,例如高达约600×106个细胞,例如高达约700×106个细胞,例如高达约800×106个细胞,或例如高达约900×106个细胞。一方面,根据本公开的细胞群能够在将约1×106个细胞至约1×109个细胞植入中枢神经系统损伤部位时,在少于约2%的对象中产生异位组织,所述细胞例如约50×106个细胞至约900×106个细胞,例如约100×106个细胞至约800×106个细胞,例如约200×106个细胞至约700×106个细胞,例如约300×106个细胞至约600×106个细胞,或例如约400×106个细胞至约500×106个细胞。一方面,根据本公开的细胞群能够在将高达约1×109个细胞植入中枢神经系统损伤部位时,在少于约2%的对象中产生异位组织。一方面,根据本公开的细胞群能够在将高达约1×109个细胞植入中枢神经系统损伤部位时,在少于约1%的对象中产生异位组织。
一方面,根据本公开的细胞群能够在对象的植入部位诱导裸露的轴突的髓鞘形成。一方面,与未经预处理产生的细胞群相比,根据本公开的方法通过预处理产生的细胞群可以表现出改善的植入和迁移能力。一方面,与未经预处理产生的细胞群相比,根据本公开的方法通过预处理产生的细胞群可以表现出改善的损伤后修复或神经组织的再生。
一方面,根据本公开的细胞群能够在将群体植入对象中后改善需要治疗的对象的感觉功能。一方面,可以使用国际脊髓损伤神经学分类标准(isncsci)检查来评估感觉功能的改善,例如确定针刺和轻触感觉的右侧和左侧的感觉水平。一方面,根据本公开的细胞群能够在将群体植入对象中后改善需要治疗的对象的运动功能。一方面,细胞群能够可持续地改善对象的运动功能持续至少两个月。一方面,细胞群能够可持续地改善对象的运动功能持续至少六个月,至少一年,至少两年或至少三年。一方面,改善的运动功能可以增加站立能力或重量支撑,增加肢体功能或肢体强度,增加步行距离,增加步行速度,增加肠或膀胱功能,增加手臂或手部运动,或增加抓(gripping),握(grasping),或者紧握(prehension)。一方面,可以使用isncsci检查来评估改善的运动功能,例如确定用于完全麻痹的右侧和左侧的运动水平,可触知或可见收缩,主动运动,抵抗重力的全范围运动以及足够的阻力。
一方面,根据本公开的细胞群能够在12个月或更短的时间内减小损伤诱导的中枢神经系统实质空化的体积。一方面,根据本公开的细胞群能够在6个月或更短,5个月或更短,4个月或更短,3个月或更短,2个月或更短,或不到1个月的时间内减小损伤诱导的中枢神经系统实质空化的体积。
一方面,来自根据本公开的细胞群的一种或多种细胞能够从有需要的对象的中枢神经系统内的第一位置迁移至一个或多个第二位置。一方面,来自根据本公开的细胞群的一种或多种细胞能够从对象的脊髓迁移至对象的脑内的受影响组织。一方面,来自根据本公开的细胞群的一种或多种细胞能够从对象脊髓内的第一位置迁移至对象脊髓内受影响组织的第二位置。一方面,来自根据本公开的细胞群的一种或多种细胞能够从对象脑内的第一位置迁移至对象脑内受影响组织的第二位置。一方面,来自根据本公开的细胞群的一种或多种细胞能够从对象脑内的第一位置迁移至对象脊髓内的受影响组织。一方面,来自根据本公开的细胞群的一种或多种细胞能够从对象脊髓内的第一位置迁移至对象脊髓内受影响组织的第二位置,以及对象大脑内一个或多个受影响组织的一个或多个位置。一方面,来自根据本公开的细胞群的一种或多种细胞能够从对象脑内的第一位置迁移至对象脑内受影响组织的第二位置,以及至对象脊髓内一个或多个受影响组织的一个或多个位置。
在一个方面,来自根据本公开的细胞群的一个或多个细胞能够在小于约150天,例如小于约100天,例如小于约50天,或例如小于约10天内从对象的中枢神经系统内的第一位置迁移到一个或多个受影响的组织处的一个或多个第二位置。一方面,来自根据本公开的细胞群的一个或多个细胞能够在约180天或更短的时间内从对象的中枢神经系统内的第一位置迁移到一个或多个受影响的组织处的一个或多个第二位置。
其他实施方式
本公开的一个方面包括含有组合物的容器,其中所述组合物包含含有多个少突胶质细胞祖细胞(opc)的细胞群,并且其中所述细胞群包含少于15%的不期望的细胞类型。一方面,不期望的细胞类型包括上皮谱系细胞。一方面,上皮谱系细胞的特征在于存在一个或多个选自下组的标志物:k7和pck。一方面,细胞群包含少于2%的k7阳性细胞。一方面,细胞群包含少于0.2%的k7阳性细胞。某些方面,细胞群包含少于5%的k7阳性细胞。一方面,细胞群具有共同的遗传背景。一方面,细胞群未经历细胞富集。一方面,容器配置用于冷冻保存。
本公开的一方面是包含组合物的容器,其中所述组合物也包含包含多个少突胶质细胞祖细胞(opc)的细胞群,并且其中所述细胞群能够在囊肿试验中形成小于或等于1个上皮囊肿/100000个细胞。一方面,细胞群能够在12个月或更短的时间内减小损伤诱导的中枢神经系统实质空化的体积。一方面,细胞群能够在180天或更短的时间内在对象的中枢神经系统组织中的一个或多个受影响的组织处从第一位置迁移到一个或多个第二位置。一方面,中枢神经系统组织是脊髓组织。一方面,中枢神经系统组织是脑组织。一方面,细胞群能够在将群体植入对象体内后改善需要治疗的对象的运动功能。一方面,细胞群能够可持续地改善运动功能持续至少两个月。一方面,运动功能是增加站立能力或重量支撑。一方面,运动功能是增加的肢体功能或肢体强度。一方面,运动功能是增加的步行距离。一方面,运动功能是增加的步行速度。一方面,运动功能是增加的肠或膀胱功能。一方面,运动功能是增加手臂或手的运动。一方面,运动功能是增加抓,握或紧握。
本公开的一方面是包含组合物的容器,其中所述组合物包含含有多个少突胶质细胞祖细胞(opc)的细胞群,并且其中所述细胞群能够在囊肿试验中形成小于或等于1个上皮囊肿/100000个细胞。一方面,细胞群能够产生一种或多种生物信号传导因子。一方面,细胞群能够产生血管生成信号因子。一方面,血管生成信号传导因子选自血小板反应蛋白-1,丝抑蛋白1,丝抑蛋白2及其组合。一方面,细胞群能够产生神经营养信号传导因子。一方面,神经营养因子选自ngf,导蛋白4,肌腱蛋白c,血小板反应蛋白1,血小板反应蛋白3,slit1,slit3及其组合。一方面,一种或多种生物信号传导因子包括核心蛋白聚糖。一方面,一种或多种生物信号传导因子包括中期因子。一方面,细胞群能够在对象的植入部位诱导裸露的轴突的髓鞘形成。
本公开的一个方面还包括含有组合物的容器,其中所述组合物包含含有多个少突胶质细胞祖细胞(opc)的细胞群,并且其中所述细胞群能够在将多至1×109个细胞植入中枢神经系统损伤部位后,在少于2%的对象中产生异位组织。一方面,在将多至1×109个细胞植入中枢神经系统损伤部位后,细胞群能够在少于1%的对象中产生异位组织。
本公开的上述方面可以进一步包括含有细胞群的组合物,其中至少30%的细胞群是ng2阳性细胞。一方面,至少40%的细胞群是ng2阳性细胞。一方面,至少50%的细胞群是ng2阳性细胞。
本公开的一方面还包括含有组合物的容器,其中所述组合物包含少突胶质细胞祖细胞(opc)群,并且其中至少95%的opc表达选自pdgf-rα,igf2,nkx2.2,olig1和巢蛋白的标志物。一方面,至少98%的opc表达选自pdgf-rα,igf2,nkx2.2,olig1和巢蛋白的标志物。一方面,至少99%的opc表达选自pdgf-rα,igf2,nkx2.2,olig1和巢蛋白的标志物。一方面,至少99.5%的opc表达选自pdgf-rα,igf2,nkx2.2,olig1和巢蛋白的标志物。一方面,100%的opc表达选自pdgf-rα,igf2,nkx2.2,olig1和巢蛋白的标志物。一方面,至少95%的opc表达选自pdgf-rα,igf2,nkx2.2,olig1和巢蛋白的第二标志物。一方面,至少98%的opc表达选自pdgf-rα,igf2,nkx2.2,olig1和巢蛋白的第二标志物。一方面,至少99%的opc表达选自pdgf-rα,igf2,nkx2.2,olig1和巢蛋白的第二标志物。一方面,至少99.5%的opc表达选自pdgf-rα,igf2,nkx2.2,olig1和巢蛋白的第二标志物。一方面,100%的opc表达选自pdgf-rα,igf2,nkx2.2,olig1和巢蛋白的第二标志物。
本公开的前述方面可进一步包含药学上可接受的运载体。一方面,药学上可接受的运载体包含二甲亚砜。一方面,药学上可接受的运载体不包含二甲亚砜。
本公开的前述方面可以进一步包括包含细胞群的组合物,其中所述组合物包含至少1×106个细胞/毫升。一方面,组合物包含1×106至5×108个细胞/毫升。一方面,组合物包含4×107至2×108个细胞/毫升。一方面,组合物的体积为20至500微升。一方面,组合物的体积为50至200微升。一方面,组合物的体积为约100微升。一方面,该组合物是注射型的溶液。一方面,该组合物适于冷冻保存。
此外,本公开的方面包括区分多潜能干细胞的方法,该方法包括用于预处理多个未分化干细胞的一个或多个步骤。一方面,涉及预处理的一个或多个步骤包括将扩增但未分化的干细胞孵育一段时间,在此期间,未分化的干细胞与一种或多种干细胞分化调节分子接触。一方面,所述一种或多种干细胞分化调节分子选自:(1)alk5的抑制剂,其是smad/tgfβ-rii信号传导通路的一部分;(2)alk2的抑制剂,它是bmpri信号传导通路的一部分;(3)用于激活wnt信号传导途径的gsk3抑制剂;和(4)用于激活shh途径的smoothened激动剂。一方面,方法包括用以下四种小分子孵育扩增但未分化的干细胞一段时间:sb431542,背吗啡,chir99021和嘌呤胺。一方面,一种方法包括在第一段时间内孵育扩增但未分化的干细胞群,在此期间,将未分化的干细胞与两种或更多种第一干细胞分化调节剂接触,并将该群体孵育第二段时间,在此期间细胞与两种或更多种第二干细胞分化调节剂接触。一方面,两种或更多种第一干细胞分化调节剂不同于两种或更多种第二干细胞分化调节剂。一方面,两种或更多种第一干细胞调节剂与两种或更多种第二干细胞调节剂相同。一方面,第一和第二干细胞调节剂共有至少一个共同调节剂。一方面,第一和第二干细胞调节剂共享两个或更多个共同调节剂,例如三个或更多个共同调节剂,例如四个或更多个共同调节剂。
目前总地提供了本发明内容,通过参照以说明方式提供的以下实施例能更容易理解本发明,但这些实施例不应限制本发明内容,除非特别说明。
实施例
实施例1-包括预处理的制备opc群的方法
来自h1系的未分化的人胚胎干细胞(uhesc)(wa01;thomsonja,itskovitz-eldorj,shapiross,waknitzma,swiergieljj,marshallvs,jonesjm.源自人胚泡的胚胎干细胞系(embryonicstemcelllinesderivedfromhumanblastocysts).sscience.1998年11月6日;282(5391):1145-7)在1∶30稀释的ko-dmem中
将uhesc暴露于小分子的混合物中以在诱导分化之前促进细胞。在分化开始之前的传代培养传代中,将细胞以约0.8-1.0×105个细胞/cm2接种,并如先前的传代一样进行培养。一旦uhesc达到30-50%汇合,将培养基更换为胶质祖细胞培养基,以10μmsb431542(西格玛奥德里奇公司(sigma-aldrich),目录号s4317),2μm背吗啡(西格玛奥德里奇公司,目录号p5499),3μmchir99021(stemgent,目录号040004)和0.5μm嘌呤胺(stemgent,目录号04-0009)的终浓度加入小分子。每天更换具有小分子的胶质祖细胞培养基,持续4天。在第四天,更换胶质祖细胞培养基,添加的小分子另有变化:3μmchir99021,0.5μm嘌呤胺和150μm抗坏血酸(西格玛奥德里奇公司,目录号a4544)。在开始分化之前,每天更换具有添加的小分子的培养基,持续接下来的三天。
然后通过使用连续使用胶原酶iv(生命技术公司(lifetechnologies),目录号17104-019)和0.05%胰蛋白酶-edta(生命技术公司,25300-054)替代烧瓶对细胞计数来实现用于定量的单细胞悬浮液,并使用pbs中的0.5mmedta收获剩余的预处理细胞培养物来启动预处理的uhesc向opc的分化。将uhesc培养物接种到超低附着(ula)容器中以在x-vivo10和胶质祖细胞培养基(gpm)的1∶1混合物中以7.33×105个细胞/cm2的密度形成胚状体(eb)。在分化的第二天,使用x-vivo10和gpm的1∶1混合物进行完全培养基更换。在这一天,gpm补充有2ng/mlhbfgf和20ng/mlegf以及10μm在dmso中的视黄酸(ra,西格玛奥德里奇公司,目录号r-2625)。从分化的第二天开始,培养基是100%gpm,仅补充20ng/mlegf和10μmra。每天更换该培养基直至第9天。从第9天开始至第27天,每隔一天更换补充有20ng/mlegf的gpm培养基。在第27天,将eb涂布在涂有
第41天opc的收获涉及补充有20u/ml全能核酸酶(emd密理博公司(emdmillipore),目录号p24-5513p3)和0.01%pluronic-f68(生命技术公司,目录号24040-032)的0.05%胰蛋白酶-edta混合物。将剥离的细胞合并在dmem-f12培养基和hypothermosolfrs(bls公司(biolifesolutions),目录号101104)的1∶1混合物中,补充有20u/ml全能核酸酶和0.01%pluronic-f68,然后在cryostor5中计数和重新配制,然后冷冻保存。
图5a显示了通过根据该实施例的方法产生的opc中表达的ng2,k7和pck标志物水平的变化与未用本文所述的小分子预处理产生的opc的比较。用预处理步骤产生的opc表达较高水平的ng2,以及较低水平的k7和pck。
实施例2-包括预处理的制备opc群的替代方法的比较
来自h1系的未分化的人胚胎干细胞(uhesc)(wa01;thomsonja,itskovitz-eldorj,shapiross,waknitzma,swiergieljj,marshallvs,jonesjm.源自人胚泡的胚胎干细胞系(embryonicstemcelllinesderivedfromhumanblastocysts).science.1998年11月6日;282(5391):1145-7)在以下基质之一上培养:1∶30稀释的ko-dmem中
将uhesc暴露于小分子的混合物中以在诱导分化之前促进细胞。在分化开始之前的传代培养传代中,将细胞以约0.2-1.3×105个细胞/cm2接种,并如先前的传代一样进行培养。一旦uhesc达到30-50%汇合,将培养基更换为胶质祖细胞培养基(gpm,如本文所述),以10μmsb431542(西格玛奥德里奇公司(sigma-aldrich),目录号s4317),2μm背吗啡(西格玛奥德里奇公司,目录号p5499),3μmchir99021(stemgent,目录号040004)和0.5μm嘌呤胺(stemgent,目录号04-0009)的终浓度加入小分子。每天更换具有小分子的胶质祖细胞培养基,持续4天。在第四天,更换胶质祖细胞培养基,添加的小分子另有变化:3μmchir99021,0.5μm嘌呤胺和150μm抗坏血酸(西格玛奥德里奇公司,目录号a4544)。在开始分化之前,每天更换具有添加的小分子的培养基,持续接下来的三天。
然后通过使用连续使用胶原酶iv(生命技术公司(lifetechnologies),目录号17104-019)和0.05%胰蛋白酶-edta(生命技术公司,25300-054)替代烧瓶对细胞计数来实现用于定量的单细胞悬浮液,并使用pbs中的0.5mmedta收获剩余的预处理细胞培养物来启动预处理的uhesc向opc的分化。将经预处理的uhesc培养物接种到超低附着(ula)容器中以在x-vivo10和胶质祖细胞培养基(gpm)的1∶1混合物中以7.33x105个细胞/cm2的密度形成胚状体(eb),其由dmem/f12(吉布可目录号10565-018),2%b27补充剂(吉布可目录号17504-044),0.04μg三碘-甲状腺素(西格玛目录号t5516-1mg),补充4ng/mlhbfgf和20ng/mlegf(生命技术目录号phg0311)组成。或者,不是使用ula组织培养容器,而是将预处理的培养物在搅拌的悬浮系统中培养以形成eb,例如0.1l一次性pbs旋转瓶,浓度为1.8×106个细胞/ml,并以25rpm搅拌。在分化的第二天,使用x-vivo10和胶质祖细胞培养基或gpm的1∶1混合物进行完全培养基更换。在这一天,gpm补充有2ng/mlhbfgf和20ng/mlegf以及10μm在dmso中的视黄酸(ra,西格玛奥德里奇公司,目录号r-2625)。从分化的第二天开始,培养基是100%gpm,仅补充20ng/mlegf和10μmra。每天更换该培养基直至第9天。从第9天开始至第27天,每隔一天更换补充有20ng/mlegf的gpm培养基。在第27天,将eb涂布在涂有
第41天opc的收获涉及补充有20u/ml全能核酸酶(emd密理博公司(emdmillipore),目录号p24-5513p3)和0.01%pluronic-f68(生命技术公司,目录号24040-032)的0.05%胰蛋白酶-edta或trypleselect的混合物。将剥离的细胞合并在dmem-f12培养基和hypothermosolfrs(bls公司(biolifesolutions),目录号101104)的1∶1混合物中,补充有20u/ml全能核酸酶和0.01%pluronic-f68,然后在cryostor5中计数和重新配制,然后冷冻保存。
参考图5b至图5f,在不同的培养条件下评估了根据该实施例的用小分子进行的uhesc预处理对opc中ng2,k7和pck标志物水平表达的影响。用预处理步骤产生的opc表达较高水平的ng2,以及较低水平的k7和pck。参考图5b1-a,在uhesc的扩增阶段期间在以下条件下产生opc:xvivo10培养基和重组层连蛋白基质,使用胶原酶iv收获扩增的es细胞。参考图5b2-a,在uhesc的扩增阶段,在以下条件下制备opc:xvivo10培养基和重组层连蛋白基质,使用胶原酶iv收获扩增的es细胞;随后将预处理的培养物在一次性pbs旋转烧瓶中培养,同时将对照培养物在ula容器中培养。参考图5c,在uhesc的扩增阶段,在以下条件下制备opc:xvivo10培养基和
实施例3-通过流式细胞术表征细胞群
流式细胞术用于通过鉴定特定标志物来量化分化群体中存在的opc的相对比例。具体地,对每个群体定量诸如ng2,巢蛋白和pdgf-rα的标志物。
为了检测细胞表面标志物的表达,用pbs洗涤细胞,并在含有10%山羊血清的染色缓冲液(含有2%fbs和0.5%叠氮化钠的pbs)中孵育以阻断非特异性结合位点。然后将特异性识别感兴趣标志物(例如ng2,巢蛋白,pdgf-rα,k7,泛细胞角蛋白等)及其同种型对照的抗体与细胞一起孵育。通过用染色缓冲液洗涤除去未结合的抗体,并且在未与荧光团缀合的抗体的情况下,使用与荧光团缀合的抗-抗体检测与细胞结合的抗体。洗涤细胞,然后加入碘化丙锭以除去死细胞。在流式细胞仪例如facscalibur上获得细胞,仅分析活细胞。通过从结合特异性抗体的细胞的百分比中减去非特异性结合同种型对照抗体的细胞的百分比来计算表达给定标志物的细胞的百分比。每个细胞的标志物表达程度计算为标志物位置群体的荧光强度与同种型对照染色细胞的荧光强度的比率。
表2是通过有或没有对未分化细胞的预处理的根据本公开内容的实施方式的方法产生的opc之间的代表性标志物表达的比较。与未经预处理的分化方法相比,包含如本文所述的预处理的方法产生表达显着更高的opc标记物ng2和pdgf-rα,以及更低的非opc标记物如oct4,tra-1-60,k7和pck的opc。
表2.通过流式细胞术对通过根据本公开内容进行和不进行预处理的方法产生的opc的代表性标志物表达
表3是通过根据本公开内容的实施方式的方法的变化产生的opc之间的代表性标志物表达的比较。列标题“第i阶段培养基”和“第i阶段过程”是指在uhesc的扩增阶段应用的条件,而列标题“第ii阶段过程”是指所应用的预处理步骤的类型:(1)对照-其中培养物未在烧瓶或旋转瓶中进行预处理;(2)预处理;(3)在旋转瓶中预处理,或(4)在玻连蛋白基质上培养时进行短预处理。在所有测试条件下,与对照相比,预处理增加了预处理产生的opc中的ng2表达,而与对照相比,预处理产生的opc中的上皮标志物k7和pck降低。
表3.通过流式细胞术的代表性标志物表达
实施例4-通过基因表达概况分析表征细胞群
基因表达概况可用于进一步表征两种最终opc群体中存在的细胞类型以及从起始hesc群体衍生的细胞类型。基因表达概况分析包括全转录组概况分析,使用诸如微阵列和rna-seq的方法,以及使用增加灵敏度的方法(例如定量实时pcr(qpcr))的靶向基因概况分析。
为了进行基因表达概况分析,根据制造商的指导,将细胞在核酸稳定溶液如凯杰公司(qiagen)的rlt裂解缓冲液(凯杰公司#79216)中裂解,并使用标准提取试剂盒如凯杰公司的rneasy小抽试剂盒(凯杰公司#74106)纯化rna。对于基于qpcr的分析,然后根据制造商的指导,通过标准方法,例如凯杰公司的rt2easy第一链试剂盒(凯杰公司#330421)将纯化的rna转化为cdna。然后使用预先制备的qpcr阵列(例如凯杰公司的rt2profilerpcr阵列(凯杰公司#330231))或单独的探针(例如凯杰公司的rt2qpcr引物阵列(凯杰公司#330001))来量化靶基因和参考管家基因的相对表达水平。根据制造商的指导,为了确定给定靶基因组的相对表达水平,在标准实时pcr机器上,例如abi7900ht实时序列检测系统(应用生物系统公司(appliedbiosystems))或等同物进行pcr反应。将每个靶基因标准化为一个或多个参考基因,例如gapdh,以确定其相对表达水平。
对于微阵列分析,根据制造商的指导,纯化的rna可用于使用标准方法例如昂飞genechipwtplus试剂盒(昂飞公司#902281)产生cdna文库,与整个转录组阵列,例如affymetrixhugene2.0st阵列(昂飞公司#902113)杂交,并使用标准仪器,例如affymetrixgenechipscanner30007g系统(昂飞公司#00-0213)进行分析。然后可以将得到的微阵列数据标准化,并且可以使用昂飞expressionconsole软件包(昂飞公司)或等同物进行相关基因表达的后续分析。
表4显示了通过根据本公开内容的实施方式的方法,有或没有预处理未分化细胞,产生的opc中的神经/胶质祖细胞基因,外胚层/神经外胚层谱系基因,和非神经外胚层谱系基因的代表性qpcr分析。本文中,在分化第9天收集rna样品,并使用上述方法处理用于qpcr。定量四种神经/胶质祖细胞基因:fabp7,neurog2,nkx2.2和olig2。定量四种早期外胚层/神经外胚层谱系基因:fgf5,foxa1,gad1和gad2。对五种早期非神经外胚层谱系基因进行定量:hand1,hand2,myl3,nppa和otx2。使用δδct方法用gapdh作为管家基因计算相对于h1hesc6opcd9的倍数表达。
参照表4,与通过未经预处理的方法产生的opc相比,根据本发明的一个方面,通过涉及预处理的方法产生的opc显示显着增加的神经/胶质祖细胞基因表达。即,神经/胶质祖细胞基因fabp7,neurog2,nkx2.2和olig2在通过涉及预处理的方法产生的opc中越来越多地表达。与未经预处理产生的opc相比,通过涉及预处理的方法产生的opc中早期外胚层/神经外胚层谱系基因gad2也显著降低。此外,当与未经预处理的方法相比时,包括根据本发明的预处理的方法导致在分化过程中非神经外胚层谱系基因的较低表达,包括滋养层谱系基因hand1的表达降低。
表4.使用根据本公开的方法分化成opc的h1hesc中的神经/胶质祖细胞基因,外胚层/神经外胚层谱系基因,和非神经外胚层谱系基因的qpcr分析。
当使用基因表达概况分析来比较通过未经预处理的方法产生的opc和使用具有根据本公开的预处理的方法产生的opc时,观察到两者的相似性和差异。两种类型的方法产生ng2阳性opc群,其也表达诸如pdgf-rα,dcn和igf2的标志物。然而,当使用包含根据本发明的预处理的方法产生opc时,与其他细胞类型相关的基因,包括诸如k7和cdh1/e-联蛋白的上皮相关基因的表达降低。
实施例5-使用体外囊肿试验评估不期望的上皮谱系细胞
使用体外囊肿试验由hesc产生的opc群中存在不期望的上皮谱系细胞。如debnath等所述进行囊肿试验,具有以下修改:(1)将细胞在24孔板中培养,每孔加入40,000个细胞;(2)培养细胞长达35天,使上皮细胞增殖和上皮结构增大的时间更长;(3)使用incellanalyzer2000(ge医疗生命科学(gehealthcarelifesciences))或类似的自动成像系统,通过免疫荧光染色和全孔图像采集检测囊肿结构;并且(4)使用分析软件如incelldeveloper软件(ge医疗生命科学)定量囊肿频率和大小。(debnathj,muthuswamysk,bruggejs,“在三维基底膜培养物中生长的mcf-10a乳腺上皮腺泡的形态发生和肿瘤发生(morphogenesisandoncogenesisofmcf-10amammaryepithelialacinigrowninthree-dimensionalbasementmembranecultures)”,methods.2003年7月;30(3):256-68。)
具体地,为了测试囊肿形成能力,细胞在已知刺激上皮囊肿形成的因子存在下在3d培养系统中生长20至35天。除了视觉检测囊肿外,还使用免疫细胞化学评估了包含上皮标记物cd49f的基底外侧蛋白表达的囊肿结构的存在。此外,利用流式细胞术检测受损啮齿动物的上皮标志物和囊肿形成,以确认通过囊肿试验测量的活性水平与体内囊肿活性之间的相关性。
当在体外囊肿试验中测试通过未经预处理的方法产生的opc时,观察到不同水平的上皮囊肿形成。参照图6a,左和中图是由未经预处理的方法产生的h1hesc衍生的opc的代表性图像,分别表现出大的和小的囊性结构。另一方面,当在体外囊肿试验中测试通过根据本发明的预处理方法产生的opc时,观察到不同的结果。图6a的右图是通过包括根据本公开的预处理的方法产生的h1hesc衍生的opc的代表性图像,其没有表现出囊性结构。
将在囊肿试验中形成囊肿的opc批次给予到成年啮齿动物的受损脊髓中,并在体内产生上皮样囊性结构。参考图6b,显示了在脊髓损伤和给予未经预处理的方法产生的h1hesc衍生的opc后9个月的成年雌性大鼠的代表性组织学,其以不同的放大倍数和不同的组织学染色显示。图6b的上图是含有损伤/opc移植部位的苏木精/曙红(h&e)染色的脊髓组织的低放大倍数图像。黑框表示上皮囊性结构的位置。图6b的下图显示了用各种组织学染色剂染色的上皮囊性结构的高放大倍数图像。左下图显示h&e染色。中央底图显示用人特异性探针halu与曙红染色,证实结构内存在人细胞。右下图显示细胞增殖标志物ki67与曙红的染色,显示囊肿内细胞的最小增殖活性。最后,图6c是通过未经预处理的方法产生的几个opc群的体内囊肿形成频率与体外囊肿计数的线性回归图,证实体外形成的囊肿数量与此动物模型中囊肿形成的频率相关。
相反,使用预处理方法和根据本发明的方法产生的opc通过流式细胞术表达较低水平的上皮标志物,并且在囊肿试验中不形成上皮囊肿(图6a,右图)。参考表5,与使用根据本发明的预处理方法产生的opc相比,通过没有预处理的方法产生的opc、产生明显更多数量的体外囊肿。
表5.来自如本文所述的囊肿试验的代表性结果,比较通过本文描述的方法产生的opc。
因为在囊肿试验中形成的囊肿大小和囊肿形成频率与群体在啮齿动物受损脊髓中形成异位囊性结构的相对能力正相关,所以使用根据本发明的预处理方法产生的opc预计在体内不会形成上皮囊肿。
实施例6-opc的植入
opc群植入哺乳动物中枢神经系统并向损伤部位迁移的能力是其生物活性的重要衡量标准,也是其效力的潜在衡量标准。此外,可以测量损伤诱导的空洞和损伤部位内有髓鞘轴突的存在,作为损伤后修复/再生的潜在替代物。
为了评估脊髓损伤的啮齿动物模型中的植入/迁移和损伤后修复/再生,使用成年雌性无胸腺裸大鼠。在opc植入之前,在期望的损伤位置对大鼠进行椎板切除术(例如用于颈部损伤的c5-c6),并且根据制造商的指导使用infinitehorizons撞击器(精密系统和仪器#ih-0400或同等产品)进行半挫伤/挤压损伤。在损伤后大约一周至一个月,将opc以2.4×105-2.4×106的剂量直接移植到损伤部位附近的脊髓中。移植后2周至12个月,然后处死动物并使用标准组织学方法处理组织。为了评估植入和迁移,固定的脊髓组织切片用人特异性探针染色,例如抗-人核抗体(密理博#mab1281),然后根据制造商的指导用适当的比色或荧光缀合的二抗染色。为了评估损伤诱导的空洞,使用标准组织学方法用苏木精和曙红溶液对固定的脊髓组织切片进行染色。然后将通过明视场显微镜收集的图像用于通过使用标准成像软件(例如imagej(nih))测量空化区域。为了评估损伤部位内髓鞘纤维的相对存在,使用标准组织学方法用铬花青染色固定的脊髓组织切片,并通过明视野显微镜成像。
当通过不进行预处理的方法产生opc并以上述方式评估时,进行了若干观察。首先,移植细胞在移植后长达12个月表现出稳健植入,并且早在移植后两周就迁移到损伤部位。相对于受到脊髓损伤并移植载剂的大鼠,移植了这些opc的大鼠早在移植后两周就表现出损伤诱导的空洞减小,并且这种效果在移植后持续长达12个月。此外,有髓鞘的轴突在移植后约3个月开始在损伤部位可见,并且在移植后增加至12个月,而有髓鞘的轴突无法穿过通常在受伤的载剂处理的大鼠中观察到的空洞部位(参见priestca,manleync,denhamj,wirthed三世,lebkowskijs,“支持脊髓损伤临床试验的人胚胎干细胞衍生的少突胶质细胞祖细胞的临床前安全性(preclinicalsafetyofhumanembryonicstemcell-derivedoligodendrocyteprogenitorssupportingclinicaltrialsinspinalcordinjury)”,regenmed.2015年11月;10(8):939-58,这些观察的示例)。
参考图7,对成年雌性大鼠进行c5颈脊髓挫伤损伤,并且移植使用涉及根据本发明的预处理的方法产生的opc。移植后两周,用抗-人核抗体(hnuc)对纵向脊髓切片进行免疫荧光染色以标记移植的细胞和用dapi以标记所有细胞核。图7显示了用dapi(左图)和hnuc(右图)标记的损伤部位(白色箭头)并在zeissaxioskop2上成像。通过涉及根据本公开的预处理的方法产生的opc表现出稳健植入和移植后两周向受伤部位迁移。
实施例7-使用opc群治疗中风
使用根据本公开的方法产生的opc可用于治疗中风。为了显示功能改善,先前建立的皮质下白质中风的小鼠模型(sozmen等,(2009)j.neuroscimethods180(2):261;hinman等,(2013)stroke44(1):182)可适应免疫缺陷的nsg小鼠(shultz等,(2007)natrevimmunol.7(20:118;jaxmice.jax.org/nod-scid-gamma)。
具体地,为了诱导局灶性缺血性病变,将n5-(1-亚氨基乙基)-l-鸟氨酸,二盐酸盐(l-nio,卡巴开公司(calbiochem))直接注射到每只小鼠的脑的胼胝体中。随后,在中风后7天,将100,000个opc/小鼠(高剂量)或10,000个opc/小鼠(低剂量)以单个1μl剂量注射到中风病灶核心附近。图8中示出了实验时间线的示例。通过每月行为测试评估神经恢复。
在这项研究中可以进行两种类型的行为测试:网格行走测试和圆柱测试。
在网格行走测试中,将动物放置在具有开口的升高的水平网格上。无脑损伤的动物通常将其爪子精确地放在线框上,以在沿着网格移动时保持自己。每当爪子滑过开口网格时记录“步伐错误”。将各肢体对侧和同侧错误的数量与所走总步数比较,然后使用脚步错误指数进行评分。
在圆筒试验中,将动物置于透明的有机玻璃圆筒中并观察。小鼠将通过竖起其后肢并用前肢和触须探查表面来积极探索垂直表面。当评价圆筒中的行为时,记录同时观察到的针对右前肢,左前肢和两个前肢的独立壁位置的数量。
可以使用总共72只小鼠建立测试组,在以下每个亚组中有12只小鼠:(1)对照(假手术),(2)仅中风,(3)opc移植到非中风动物中(一半移植低剂量opc,另一半移植高剂量opc),(4)低剂量opc在中风病灶附近移植入中风动物,(5)高剂量opc在中风病灶附近移植入中风动物,和(6)高剂量opc在中风病灶内移植入中风动物。
在图9和图10中描绘了可以根据该示例执行的实验生成的预期数据。
参考图9,预期网格行走测试中的性能表现出在中风和根据本公开内容的一个方面产生的opc移植后四个月改善的精细运动控制和步态。
参考图10,预期圆筒测试中的性能在根据本公开的一个或多个方面产生的opc移植后4个月显示出改善。
实施例8-使用opc群治疗脊髓损伤
使用根据本公开的方法产生的opc可用于治疗脊髓损伤。使用行为和组织学评估进行功效研究以测试颈脊髓损伤的大鼠模型中的opc。这项研究模拟了最常见的人类脊髓损伤,宫颈挫伤,并限制为半挫伤,以保持稳定的动物生存和维持合理的动物饲养需求。使用根据本发明的未经预处理的方法产生的opc进行初步研究。
雌性无胸腺rnu大鼠接受颈部c-6单侧(右)脊髓挫伤,使用infinitehorizons撞击器设置以提供250kdyne挫伤力。一周后,挫伤动物接受2.4×105个opc,或载剂(hbss),或假手术。所有动物均接受抗脱唾液酸gm1抗体的免疫抑制。在研究期间的四个时间点(基线和移植后1个月,2个月或4个月)进行行为和运动学测试,之后收集脊髓用于组织学评估。
为了给予opc或载剂,使用立体定位操纵臂将注射器降低到脊髓中。通过单次注射2.4μl将载剂或opc给予损伤部位尾侧的脊髓背侧薄壁组织。
为了评估损伤和治疗后的行为恢复,本研究结合了treadscan步态分析系统(聪明系统公司(cleversysinc.),莱斯顿,弗吉尼亚),该系统允许定量测量90种不同的运动属性和步态力学。
对于treadscan分析,将动物置于机动清晰的跑步机上,并在无限制的运动期间使用高速摄像机从腹侧平面成像20秒。然后使用treadscan分析系统软件计算四只爪中每一只的步态属性。
使用这些步态参数,多因素方法用于统计分析整个数据集。进行第一主成分(pc)分析以将90个单独的treadscan测量值压缩为四个时间点中的每一个的43个动物中的每一个的一个值。从基线绘制,第一pc(图11)显示受伤动物在受伤后第一个月内与未受伤的假手术组的分歧。第一个月后,接受opc的动物恢复了一些自主活动,而接受hbss载剂的动物恢复很少(p≤0.05)。功能改善在移植后2个月开始出现,并在4个月时继续增加。
用于生成第一主成分的多变量分析还确定了对总分最负责的各个参数。前三个参数是运行速度,右后跨步频率和右前最大纵向偏差。这三个参数分别绘制在图12,图13和图14中,针对接受通过未经预处理的方法产生的opc的受损大鼠。
参考图12,在4个指定的时间点绘制未受伤的假大鼠,接受载剂的受损大鼠和接受opc的受损大鼠的平均运行速度。在基线时,所有组的动物以相似的速度跑步。损伤后一个月,用opc或载剂(hbss)治疗的动物比假动物慢,表明损伤的影响。在两个月和四个月时,假和opc治疗组都以相似的改善率提高了他们的跑步速度。相比之下,hbss载剂组在整个研究中的跑步速度几乎没有增加。在治疗后2个月和4个月时,移植opc的动物在跑步速度方面比载剂对照组的动物具有统计学上明显更快的跑步速度(p≤0.05)。
参考图13,在4个指定的时间点绘制未受伤的假大鼠,接受载剂的受损大鼠和接受opc的受损大鼠的右后步频。接受通过未经预处理的方法产生的opc的动物在移植后受到的较不严重的损害。具体地,用opc处理的动物的右后步频与假动物的右后步频接近,高于hbss载剂处理的受损大鼠(图13),并且与载剂组明显不同(p≤0.05)。
参照图14,在4个指定的时间点绘制未受伤的假大鼠,接受载剂的受伤大鼠和接受通过未经预处理的方法产生的opc的受伤大鼠的右前最大纵向偏差。这测量了右前脚(受伤侧)相对于短体轴(腰轴)的最大距离。本文中,接受opc的动物显示受影响的右前肢的纵向位移,其更接近于假动物的纵向位移,并且与接受hbss载剂的动物在统计学上不同(图14)。
来自功效研究的死后组织学分析显示opc处理的大鼠具有存活的opc,实质腔形成的减少和穿过损伤部位的有髓纤维的存在(图15)。细胞核用人核抗原染色,髓磷脂用铬花青染色。tract追踪从opc移植物内并在损伤部位追踪尾部的红核脊髓和网状脊髓束中识别轴突纤维。参照图15的左图,观察到移植的opc完全填充病变腔。图15的右图显示opc移植物内存在有髓鞘轴突(箭头)。
treadscan分析表明,通过未经预处理的方法产生的opc能够逆转由大鼠颈髓的挫伤引起的运动缺陷。因此,在通过未经预处理的方法产生的opc移植的受伤动物中观察到运动学测量和脊髓组织组织学的改善。
预期通过预处理方法产生的opc的移植将提供至少相同水平的功能改善,其通过移植未经预处理的方法产生的opc提供。
实施例9-使用opc群治疗多发性硬化
使用根据本发明的方法产生的opc可用于治疗多发性硬化症(ms),其是一种自身免疫疾病,导致中枢神经系统中轴突的脱髓鞘。为了测试opc重新髓鞘化受损轴突和恢复运动功能的能力,使用基本上如stosic-grujicic等所述的ms啮齿动物模型(stosic-gruiicics,ramicz,bumbasirevicv,harhajil,mostaricastojkovicm.“在没有佐剂的情况下诱导da大鼠中实验性自身免疫脑脊髓炎(inductionofexperimentalautoimmuneencephalonmyelitisindarkagoutiratswithoutadjuvant)”.clin.exp.immunol.2004.136:49-55)。该模型使用通过用髓鞘少突胶质细胞糖蛋白mog1-125免疫给予实验性自身免疫性脑脊髓炎(eae)的da大鼠。图16中示出了实验概要的非限制性实例,在免疫后第30天进行opc移植。
为了检查opc移植对试验动物行为的影响,使用stosic-grujicic等,2004中描述的评分系统确定每只动物的临床评分。图17显示了可以根据该实施例进行的实验产生并且通过比较对照组和移植有根据本公开内容的一个方面产生的opc的动物获得的预期数据。对脱髓鞘动物模型中未经预处理产生的opc的移植的电子显微镜检查和组织学分析表明植入的opc移植物并产生髓磷脂。
总之,这些结果表明,通过未经预处理的方法产生的opc的移植具有在eae模型中逆转运动功能障碍和髓鞘形成障碍的潜力。
预期通过具有预处理的方法产生的opc的移植将在ms的eae模型中提供至少相似水平的髓鞘再生和功能改善。
虽然参考具体方面对本发明进行了描述,但本领域技术人员应理解可在不背离本发明范围的情况下作出各种改变并且可以用等同方式替代其元件。此外,可以进行许多修改以使特定情况或材料适应于本公开的教导,而不背离其范围。
因此,本公开不限于作为预期实施本公开的最佳模式而公开的特定方面,而是本公开将包括落入所附权利要求的范围和精神内的所有方面。
- 还没有人留言评论。精彩留言会获得点赞!