一种渔用二联口服微球疫苗及其用途的制作方法
本发明涉及一种渔用二联口服微球疫苗及其用途。
背景技术:
随着水产养殖业的高速发展,集约化的养殖模式导致各种疾病的频繁暴发,伴随水产品贸易的全球化,疾病的流行与传播也变得更加容易。与此同时生产上因药物滥用使细菌产生耐药性,带来药物残留,食品安全,环境污染等问题。加之病鱼摄食下降甚至不进食致使药物治疗非常困难。因此疫苗的使用成为了疾病预防的重要手段。目前多数渔用疫苗通过注射进行免疫,存在工作量大,易对鱼体造成应激等缺点。口服疫苗作为鱼类最有前景的免疫方式,不仅免疫操作方便,且应激小,二联或多联口服疫苗的使用还能同时预防多种病原体引起的疾病。
鮰爱德华氏菌病和鲁氏耶尔森氏菌病是分别由鮰爱德华氏菌E.ictaluri和鲁氏耶尔森氏菌Y.ruckeri引起疾病,是斑点叉尾鮰的两种重要细菌性疾病,已经对斑点叉尾鮰的养殖产生了较大的影响,预防其在更大范围的暴发尤为重要。
目前关于斑点叉尾鮰鮰爱德华氏菌病和鲁氏耶尔森氏菌病二联口服疫苗的研究还未见报道。
技术实现要素:
为了解决上述问题,本发明提供了一种斑点叉尾鮰鮰爱德华氏菌病和鲁氏耶尔森氏菌病二联口服疫苗及其制备方法和用途。
本发明渔用二联口服微球疫苗,它包括鮰爱德华氏菌微球疫苗以及鲁氏耶尔森氏菌微球疫苗,其中,鮰爱德华氏菌微球疫苗、鲁氏耶尔森氏菌微球疫苗按照如下方法制备:
(1)取鮰爱德华氏菌或者鲁氏耶尔森氏菌,制成菌液,灭活,得灭活疫苗;
(2)在灭活疫苗中加入海藻酸钠至终浓度为3.5%(w/v),混匀,得混合溶液,将混合溶液滴加到液体石蜡中,其中,混合溶液与液体石蜡的体积为为2.4:7.6,乳化,得乳液;
(3)将乳液滴加到等体积浓度为7%(w/v)的CaCl2溶液中,再加入浓度为0.05mol/L的CaCl2溶液,静置,去除上层油相和水,离心,收集微球,清洗,即可。
优选地,所述鮰爱德华氏菌微球疫苗与鲁氏耶尔森氏菌微球疫苗的体积比为1:1。
优选地,步骤(1)中,所述菌液中,鮰爱德华氏菌或者鲁氏耶尔森氏菌的浓度为4×109cfu/mL。
优选地,步骤(1)中,所述灭活的方式是:加入福尔马林至终浓度为0.3%(w/v),120r/min、28℃条件下灭活24h。
优选地,步骤(2)中,所述液体石蜡中添加有乳化剂,乳化剂为Span-80,乳化剂的浓度为5.4%(w/v)。
优选地,步骤(2)中,乳化的方式是:2000r/min搅拌13min。
优选地,步骤(3)中,静置的时间是1h。
优选地,步骤(3)中,离心的转速为8000r/min,离心的时间为5min。
优选地,步骤(3)中,清洗的方式为乙醇清洗3次,再用去离子水清洗3-4次。
本发明还提供了前述的疫苗在制备预防鮰爱德华氏菌病和/或鲁氏耶尔森氏菌病中的用途。
本发明以斑点叉尾鮰源鮰爱德华氏菌和鲁氏耶尔森氏菌灭活疫苗为细菌抗原,天然高分子聚合物海藻酸钠为口服疫苗载体制备海藻酸钠二联口服微球疫苗,并对疫苗免疫保护效果进行研究,从非特异性免疫指标、抗体效价、相对免疫保护率和免疫相关基因的表达等方面综合评价二联疫苗的保护效果,为生产上方便、安全和有效的预防斑点叉尾鮰鮰爱德华氏菌病和鲁氏耶尔森氏菌病开发一种新型的渔用疫苗。
本发明二联微球疫苗可以有效保护斑点叉尾鮰免受鮰爱德华氏菌和鲁氏耶尔森氏菌的感染,预防鮰爱德华氏菌病和鲁氏耶尔森氏菌病,使用方便,应用前景良好。
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
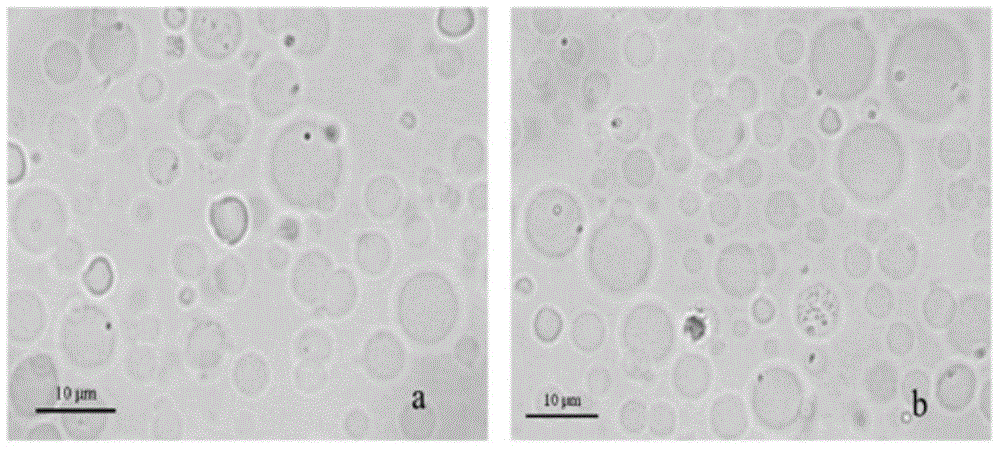
图1工艺优化后制备的海藻酸钠微球形态(1000×)。a:鮰爱德华氏菌微球疫苗;b:鲁氏耶尔森氏菌微球疫苗。
图2海藻酸钠微球粒径分布。a:鮰爱德华氏 菌微球疫苗;b:鲁氏耶尔森氏菌微球疫苗。
图3不同条件下海藻酸钠微球体外模拟释放曲线。a:鮰爱德华氏菌微球疫苗;b:鲁氏耶尔森氏菌微球疫苗。
图4斑点叉尾鮰血清总蛋白含量变化。注:将各实验组与对照组总蛋白含量进行差异显著性分析,“*”表示差异显著(p<0.05),“**”表示差异极显著(p<0.01)。
图5斑点叉尾鮰血清总超氧化物歧化酶活力变化。注:将各实验组与对照组总超氧化物歧化酶活力进行差异显著性分析,“*”表示差异显著(p<0.05),“**”表示差异极显著(p<0.01)。
图6斑点叉尾鮰血清溶菌酶活力变化。注:将各实验组与对照组溶菌酶活力进行差异显著性分析,“*”表示差异显著(p<0.05),“**”表示差异极显著(p<0.01)。
具体实施方式
实施例1 本发明二联口服疫苗的制备
1细菌复壮
将-40℃保存的鮰爱德华氏菌E.ictaluri菌和鲁氏耶尔森氏菌Y.ruckeri菌分别在BHI、LB固体培养基划线,E.ictaluri 28℃培养24h及Y.ruckeri 28℃培养24h后,染色镜检验纯。取两种菌分别腹腔注射攻毒健康斑点叉尾鮰。待鱼死后,从鱼体无菌分离病原菌,接种平板分别培养,再挑取单个菌落接种于肉汤培养基,进行PCR鉴定,然后再攻毒斑点叉尾鮰,连续复壮三次。
2灭活疫苗制备
将扩大培养的E.ictaluri经验纯后调整菌液浓度为4×109cfu/mL,然后用锥形瓶分装适量菌液并加入终浓度为0.3%的福尔马林于摇床120r/min,28℃灭活24h。
将扩大培养的Y.ruckeri经验纯后调整菌液浓度为4×109cfu/mL,然后用锥形瓶分装适量菌液并加入终浓度为0.3%的福尔马林于摇床120r/min,28℃灭活24h。
将灭活完全的细菌用无菌生理盐水洗涤3次,置于冰箱4℃保存备用。
3海藻酸钠微球疫苗制备工艺流程
取适量海藻酸钠与E.ictaluri灭活疫苗充分混合,使混合溶液中海藻酸钠浓度为3.5%,将混合溶液缓慢滴加到一定量液体石蜡(含乳化剂Span-80,液体石蜡中乳化剂浓度为5.4%)中,使混合溶液与液体石蜡的体积比为2.4:7.6,2000r/min搅拌13min,待充分乳化后,将上述乳液滴加到等体积的7%(M/V)CaCl2溶液中钙化形成微球,再将0.05M的CaCl2水溶液缓慢倾入上述溶液中静置1h后去除上层油相和水,8000r/min离心5min收集微球,用乙醇清洗3次,再用去离子水清洗3-4次,收集微球。
4.微球疫苗表面形态及粒径分析
取少量微球溶液于载玻片上,盖上盖玻片后用显微成像系统观察形态并拍照。从中随机选取600个微球,利用图像分析软件Image-pro-pius 6.0测量粒径大小,SPSS软件对粒径分布情况进行统计分析。粒径分布用跨距来表示,计算公式:
跨距=(D90-D10)/D50
式中D10,D50,D90分别指粒径累积分布图中10%、50%、90%处所对应的粒径。
5.包封效率测定
将收集到的微球重悬,取3mL微球悬液离心,将得到的微球加入到适量55mM柠檬酸钠溶液中120r/min摇床过夜,充分溶解。再将溶液10000r/min离心10min,将所收集细菌用紫外分光光度计于600nm处测定细菌OD值,按照公式计算包封效率:
包封效率(%)=(微球中的细菌OD值/理论微球中细菌OD值)×100%
6.疫苗安全性检验
取少量微球疫苗涂布于BHI平板,于28℃条件下培养48h,观察有无细菌生长。
将40尾健康斑点叉尾鮰分为4组,每组10尾。分别将制备好的微球疫苗以1×109cfu/尾的浓度灌胃、腹腔注射接种,设置无菌PBS灌胃、腹腔注射对照组,观察统计14d内接种鱼的发病情况及存活率。
7.体外模拟释放试验
为了检测微球疫苗在胃肠条件下的稳定性,参照Tian等[97]以及Rodrigues等[66]的方法,配置模拟胃液(pH 2.0的PBS溶液)及模拟肠液(pH 9.0的Tris-HCl溶液)检测微球的稳定性。
参照Leal等[101]的方法,分别取适量制备好的微球疫苗分散于5ml模拟胃液、模拟肠液以及先在模拟肠液胃液中反应6h后再转移至模拟肠液中继续反应,22℃下反应,分别于1、3、6、9、12、15、18、21和24h取上清液500r/min离心1min用紫外分光光度计于600nm处测定细菌的OD值,重复测定3次取平均值,根据公式计算微球疫苗的释放率,并绘制释放曲线。
释放率(%)=(上清液中的细菌OD值/微球中细菌OD值)×100%
8.疫苗及疫苗饲料制备
二联灭活疫苗制备:浓度为4×109cfu/mL的E.ictaluri和Y.ruckeri灭活疫苗按1:1比例(体积比)混合均匀制成二联灭活疫苗,4℃保存备用。
二联海藻酸钠口服疫苗制备:制备E.ictaluri微球疫苗、Y.ruckeri微球疫苗以及海藻酸钠空微球,将制备好的E.ictaluri、Y.ruckeri微球疫苗调整抗原浓度1×109cfu/mL,按1:1比例混合均匀制成二联口服疫苗,4℃保存备 用。
将制备好的疫苗及空微球分别按所需免疫剂量(表1)与粉碎后的饲料混合再成型、干燥制成疫苗饲料,按照体重的2%进行投喂。
表1免疫程序
注:海藻酸钠空微球组免疫剂量M等于Ⅰ组中微球疫苗质量;实验水温(22±2)℃
9.血清采集与处理
免疫接种后第1、2、3、4、5、6、7、8周分别从各免疫采样组随机取6尾鱼,用MS222溶液(1mg/L)麻醉,尾静脉采血,每尾0.2ml。将采集血液室温静置1h后于4℃冰箱中保持4h,4℃条件下4000r/min离心l0min,收集上层血清,-80℃保存备用。
10免疫指标检测
10.1血清总蛋白含量检测
利用蛋白定量(考马斯亮蓝法)测试盒(购自南京建成生物工程研究所)测定各组血清中总蛋白的含量。
将试剂盒中的考马斯亮蓝贮备液与双蒸水1:4配置成工作液,现配现用。取3支无菌4mL离心管,分别标记为空白管、标准管和测定管,依次加入50μL蒸馏水、50μL蛋白标准液(0.563g/L)和50μL待测血清,再每管加入3mL双缩脲试剂,混匀,静置10min,波长595nm,1cm光径,蒸馏水调零,测各管OD值。按下列公式计算总蛋白含量:
血清总蛋白含量(mg/mL)=(测定管OD值-空白管OD值)/(标准管OD值-空白管OD值)×蛋白标准品浓度(mg/mL)。
10.2血清总超氧化物歧化酶(T-SOD)活性检测
利用T-SOD试剂盒(购自南京建成生物工程研究所)测定各组血清T-SOD酶活力。
取2支离心管,分别标记为对照管和测定管,依次加入一定量的蒸馏水和待测血清,再向每管分别加入试剂1、2、3、4后,充分混匀,37℃水浴40min。水浴后每管中加入2mL显色剂,混匀,室温放置10min,蒸馏水调零,于波长550nm处测定OD值。按下列公式计算T-SOD活力:
T-SOD活力(U/mL)=(对照管OD值-测定管OD值)/(对照管OD值)/50%×反应体系的稀释倍数×样本测试前的稀释倍数
10.3血清溶菌酶活力检测
血清溶菌酶活力测定,利用冻干的微球菌粉通过浊度进行测定。首先将待测血清用柠檬酸盐缓冲液(pH5.5,0.02M)10倍稀释,取20μL加入到U型底96孔板中,每个样品具有3个重复。然后每孔加入浓度为0.2mg/ml的微球菌粉200μL,迅速在OD值450nm的吸光度下测定初始的吸光度,然后将含有底物的待测样品放置于37℃恒温箱孵育1h,在相同的450nm吸光度下测定最终的OD值。并采用相同的方法,以鸡蛋白溶菌酶做标准曲线,测定值应该在标准曲线有效范围之内。溶菌水平以U/ml表示,0.001/min表示一个单位U。
10.4微量凝集实验检测血清抗体水平
10.4.1抗原制备
同2灭活疫苗制备,将E.ictaluri、Y.ruckeri灭活,调整细菌浓度为3×108cfu/mL。
10.4.2最佳反应条件的确定
最佳抗原浓度的选择:用PBS将抗原按1:2,1:4,1:8倍比稀释,与血清进行微量凝集试验。
最佳反应温度的选择:将微量凝集板分别置于37℃和28℃条件下反应,过夜,观察反应温度对反应的影响。
10.4.3实验步骤及判定标准
向96孔板1-12孔中加入50μL PBS,再向第1孔中加入50μL待测血清,吹打8-10次,取50μL加入第2孔,依次倍比稀释,至第10孔,弃去50μL,末尾2孔不加血清作为抗原对照,然后每孔中加入最佳浓度的抗原50μL,同时设阳性、阴性对照,混匀后于最佳反应温度下反应,过夜,观察记录结果。
结果判定标准:
*:上清液澄清,孔底部中央有大量致密凝集结构聚集,边缘有大量凝集片;
+++:上清液较澄清,孔底部中央有较多凝集结构,边缘有较多凝集片;
++:孔底部有连片沉淀,与抗原对照孔不同,边缘有少量凝集片;
+:孔底部凝集结构点状分布,边缘微量凝集痕迹;
-:孔底部无明显的凝集结构,与抗原对照孔相似,边缘无凝集痕迹;
以出现“++”的最高抗体稀释倍数为抗体的凝集效价
10.5攻毒试验及免疫保护效果测定
10.5.1鮰爱德华氏菌对斑点叉尾鮰半数致死量LD50的测定
用无菌生理盐水倍比稀释E.ictaluri细菌悬液,将试验斑点叉尾鮰分为5组,每组10尾。每尾腹腔注射相应细菌稀释液0.2ml。攻毒后观察7-14天,记录试验鱼发病及死亡情况。用寇氏法计算LD50。
10.5.2鲁氏耶尔森氏菌对斑点叉尾鮰半数致死量LD50的测定
以2.6.1方法计算Y.ruckeri对斑点叉尾鮰半数致死量LD50。
10.5.3攻毒试验
于免疫后第29天,进行攻毒试验,以50×LD50浓度攻毒,腹腔注射0.2mL/尾。Ⅰ、Ⅱ组用E.ictaluri攻毒;Ⅲ、Ⅳ组用Y.ruckeri攻毒;Ⅴ、Ⅵ组用两种菌分别攻毒,记录攻毒后14d内各组鱼的发病及死亡情况,另取濒死鱼体的肝、肾进行接菌培养,确定病原菌种类。并计算相对保护率(Relative Percent Survival,RPS),按下列公式计算:
RPS(%)=[(对照组死亡率—免疫组死亡率)/对照组死亡率]×100%
10.6攻毒试验及免疫保护效果测定
于免疫后第29天,进行攻毒试验,以50×LD50浓度攻毒,腹腔注射0.2mL/尾。每组分别用E.ictaluri、Y.ruckeri攻毒,记录攻毒后14d内各组鱼的发病及死亡情况,另取濒死鱼体的肝、肾进行接菌培养,确定病原菌种类。并计算相对保护率(Relative Percent Survival,RPS),按下列公式计算:
RPS(%)=[(对照组死亡率—免疫组死亡率)/对照组死亡率]×100%
3结果
3.1微球疫苗表面形态及粒径分析
本发明海藻酸钠微球疫苗成球性好(图1),粒径分布均匀(图2),鮰爱德华氏菌微球疫苗粒径(8.88±1.26)μm,跨距0.38。鲁氏耶尔森氏菌微球疫苗粒径(8.76±1.73)μm,跨距0.47。
3.2微球疫苗包封效率
相同工艺下平行验证实验结果稳定性,鮰爱德华氏菌微球疫苗平均包封效率为96.37%。
鲁氏耶尔森氏菌海藻酸钠微球疫苗,其平均包封效率为94.51%。
3.3微球疫苗安全性检验
分别取适量鮰爱德华氏菌、鲁氏耶尔森氏菌灭活疫苗与微球疫苗涂布于BHI平板,各设3个重复,28℃条件下培养48h观察,均无细菌生长。
将制备好的2种微球疫苗以1×109cfu/尾灌胃、腹腔注射接种健康斑点叉尾鮰,设置无菌PBS腹腔注射对照组,14d内接种鱼未见任何异常,均无发病或死亡(表2,3),证明疫苗安全性良好。
表2鮰爱德华氏菌微球疫苗安全性实验结果
表3鲁氏耶尔森氏菌微球疫苗安全性实验结果
3.4微球疫苗体外模拟释放
在模拟胃液(pH 2.0)中,微球的释放率极低,鮰爱德华氏菌微球疫苗和鲁氏耶尔森氏菌微球疫苗24h累积释放率分别为10.7%和12.9%;当微球在模拟肠液(pH 9.0)中时,出现了起始的突释现象(23%和26%),然后持续快速的释放,24h累积释放率分别为87%和89%(图3)。
为了更准确的模拟疫苗口服后在鱼胃肠道环境中的释放行为,将微球首先在模拟胃液中处理6h,再转移至模拟肠液中继续处理,鮰爱德华氏菌微球疫苗24h累积释放率89%。经过模拟胃液的处理,当微球转移至模拟肠液后,表现出更快的释放速率,18h累积释放率83.4%,而在模拟肠液中处理的微球18h累积释放率为80%。
鲁氏耶尔森氏菌微球疫苗在模拟胃液中处理6h后转移至模拟肠液中,24h累积释放率92%,转移至模拟肠液中18h累积释放率87.9%,远高于仅在模拟肠液中处理的微球18h累积释放率70%。
3.5血清总蛋白含量检测
免疫后各组斑点叉尾鮰血清总蛋白含量变化见图4。在免疫后第1周,除二联灭活疫苗组,各试验组血清总蛋白含量均显著升高(p<0.01),在实验的第2周各实验组血清总蛋白含量周达到峰值,二联微球疫苗低、中、高 剂量组至第7周仍显著高于对照组(p<0.05);二联灭活疫苗仅在第2、3、5周与对照组差异极显著(p<0.01),其余周次差异不显著(p>0.05);空微球组血清总蛋白在实验第1、2周显著高于对照组,之后快速下降至与对照组差异不显著水平(p>0.05)。在整个实验期间二联微球疫苗组血清总蛋白含量普遍高于其它各组;在整个实验期间,对照组血清总蛋白含量相对稳定在50-55mg/mL。
3.6血清总超氧化物歧化酶活性检测
对各组斑点叉尾鮰免疫后,血清总超氧化物歧化酶活力变化情况见图5。从第1周开始各组T-SOD活力均呈上升趋势,且各实验组第1周酶活力均显著高于对照组(p<0.01)。峰值出现在第2周,之后开始下降,二联微球疫苗低剂量组至第7周血清T-SOD活力仍显著高于对照组(p<0.05),且在整个实验第2-7周,低剂量组血清T-SOD活力均高于其它实验组及对照组,;二联微球疫苗中、高剂量组至第6周显著高于对照组(p<0.01)。二联灭活疫苗在免疫后迅速引起T-SOD活力升高,但是下降速度快,至第5周时与对照组差异不显著(p>0.05);空微球组在整个试验期间血清T-SOD活力均低于疫苗组,仅在第1、2、3周时显著高于对照组(p<0.01),之后降低至与对照组差异不显著(p>0.05)。在整个试验期间,对照组血清总超氧化物歧化酶活力相对稳定在118-124U/mL。
3.7血清溶菌酶含量检测
免疫后各组斑点叉尾鮰血清溶菌酶活力变化见图6。从第1周开始,各试验组血清溶菌酶活力均出现显著性升高(P<0.01)。实验第1、2周二联微球疫苗高剂量组和二联灭活疫苗血清溶菌酶活力显著高于其它组(P<0.01),但在第2周达到峰值后,二联微球疫苗低、中剂量组溶菌酶活力显著高于其它实验组及对照组(P<0.01),至第7周,二联微球疫苗低、中剂量组溶菌酶活力仍与对照组差异极显著(P<0.01);二联灭活疫苗组溶菌酶活力免疫后也开始升高,但相对微球疫苗组,灭活疫苗组溶菌酶活力降低更快;空微球组溶菌酶活力在实验期间均低于其它实验组,高水平的酶活力持续时间也较短,至第5周时与对照组差异不显著(p>0.05)。在整个试验期间,对照组血清溶菌酶活力相对稳定在105-111U/mL。
3.8微量凝集实验检测血清抗体水平
在最佳反应条件下进行微量凝集实验结果见表4,5。以鮰爱德华氏菌为凝集实验抗原时:二联微球疫苗低、中、高剂量组以及二联灭活疫苗组在第3周时可检测到特异性抗体,但抗体效价较低,仅为1:2,之后抗体水平上升,二联微球疫苗低、中、高剂量组均在第5周达到峰值,分别为1:32、1:16、1:8,之后降低,第8周时二联微球疫苗低、中、高剂量组仍可以检 测到特异性抗体效价为1:2。二联灭活疫苗组在第3、4、5周检测到特异性抗体,但水平都较低,仅为1:2,其余周次均未能检测到特异性抗体。空微球组和对照组均无特异性抗体检出(表4)。
以鲁氏耶尔森氏菌为凝集实验抗原时:二联微球疫苗低、中、高剂量组以及二联灭活疫苗组在第4周时检测到特异性抗体,但抗体效价较低,之后抗体水平上升,二联微球疫苗低、中、高剂量组均在第5周达到峰值,分别为1:16、1:8、1:8。至第8周时二联微球疫苗低、中剂量组仍能检测到低水平的特异性抗体。二联灭活疫苗在第4、5、6周时检测到特异性抗体,效价最高为1:4。空微球组和对照组均无特异性抗体检出(表5)。
表4微量凝集检测抗体效价
注:微量凝集实验以鮰爱德华氏菌为抗原;“-”代表阴性,即血清与抗原不发生明显凝集
表5微量凝集检测抗体效价
注:微量凝集实验以鲁氏耶尔森氏菌为抗原;“-”代表阴性,即血清与抗原不发生明显凝集
3.9免疫保护率
在整个实验期间,攻毒前,实验用斑点叉尾鮰均未出现死亡等异常情况。各实验组按体重2%口服免疫饲料一个免疫周期(7d),于免疫后第29天进行攻毒。结果表明,用鮰爱德华氏菌攻毒实验组和对照组,二联微球疫苗低、中、高剂量组以及二联灭活疫苗组分别获得抗鮰爱德华氏菌相对免疫保护率为75.0%、67.9%、60.7%和39.3%;空微球组保护率为10.7%,正常饲料对照组在攻毒后14天内,死亡率93.3%(表6)。
用鲁氏耶尔森氏菌攻毒实验组和对照组,二联微球疫苗低、中、高剂量组以及二联灭活疫苗组分别获得抗鲁氏耶尔森氏菌相对免疫保护率为 65.5%、69.0%、65.5%和34.5%;;空载体组保护率为10.3%,正常饲料对照组在攻毒后14天内,死亡率96.7%(表7)
表6攻毒后斑点叉尾鮰死亡率和相对免疫保护率
表7攻毒后斑点叉尾鮰死亡率和相对免疫保护率
综上,本发明二联微球疫苗可以有效保护斑点叉尾鮰免受鮰爱德华氏菌和鲁氏耶尔森氏菌的感染,预防鮰爱德华氏菌病和鲁氏耶尔森氏菌病,使用方便,应用前景良好。
- 还没有人留言评论。精彩留言会获得点赞!