包含第一生物降解性微珠及第二生物降解性微珠的化疗栓塞用组合物及其制备方法与流程
本发明涉及以规定比例包含具有不同的抗癌剂释放特性的第一生物降解性微珠及第二生物降解性微珠的化疗栓塞用组合物及其制备方法。
背景技术:
近来,随着影像技术的发展,可以找出隐藏在体内的癌肿的准确位置,并利用放射线照射、内窥镜手术等的多种方法来去除癌肿。但是,即使准确地发现癌肿的位置,也存在因癌肿扩散至整个脏器或紧贴于其他脏器等的多种原因,而无法通过手术来去除的情况。肝癌、胰腺癌等的情况即使被发现,也无法通过手术来进行根治的情况较多。
目前,化疗栓塞术(Transarterial Chemoembolization,TACE)作为在肝肿瘤的治疗中最为广泛施行的手术之一,是一种找出向肝肿瘤提供营养的动脉,并将抗癌剂进行给药之后闭塞血管的治疗方法。肝组织利用经过小肠及大肠等的门静脉(portal vein)和从大动脉直接延伸形成的肝动脉接收氧气和营养,正常的肝组织是主要从门静脉中接收血液,肿瘤组织是主要从肝动脉中接收血液。因此,若在向肿瘤供给营养的肝动脉上将抗癌剂进行给药之后闭塞血管,则在不损伤正常肝组织的情况下,可以选择性地仅使肿瘤坏死。这种治疗方法没有与癌肿的发展程度相关的约束,因此具有适用范围广、对治疗对象的限制少等的诸多优点,因此目前在提高肝癌的治愈率的方法中做出了最大贡献。化疗栓塞术先在位于腹股沟的股动脉插入导管,来接近肝动脉之后,通过注射血管造影剂来取得肿瘤的位置、大小及血液供给状态等的治疗上所需的信息,当确定治疗方针时,将具有约1mm左右厚度的细管插入于导管,并找出靶动脉之后进行手术。
目前,在临床上应用最频繁的代表性的方法为利用碘油的肝动脉栓塞法,并且具有很多有关利用这些方法的专利技术方面的报道。由于碘油大量包含作为组成成分的碘,因而具有可进行电子计算机断层扫描(Computed Tomography,CT)影像的优点,由此为手术提供了方便。但是,存在为了载入阿霉素而在手术之前需要将溶解有药物的注射液和油状的碘油进行振荡来混合的缺点。并且,据有关临床上的报道有手术之后,溶解在水中的阿霉素未被积累在肝癌部位,急速地流向全身血液,因此不仅未能得到充分的抗癌效果,而且患者对药物的副作用也相当大。
在美国专利7,442,385号中叙述了如下的方法,即,通过交联聚乙烯醇(poly vinyl alcohol,PVA)来制备微尺寸的颗粒之后,利用电引力在微珠的表面吸附作为抗癌剂的阿霉素,并向肝癌部位传递,从而同时实现抗癌剂的持续性释放和栓塞效果。为此,在交联聚乙烯醇的过程中,在交联末端上与作为阴离子单体的2-丙烯酰胺-2-甲基丙磺酸(2-acrylamido-2-methylpropane sulfonic acid,AMPS)形成共价键,来改质聚合物,由此可吸附如阿霉素等的阳离子药物。但是,在利用聚乙烯醇的肝动脉栓塞术中,由于形成交联的聚乙烯醇在体内中未被分解,因此肝肿瘤坏死之后,因聚乙烯醇微珠以非特定的方式进行扩散而引起炎症,或者更为担心的是,在沿着血管扩散至其他脏器的情况下,会引起脑血栓等的问题。因此,需要可同时取得作为可以改善问题的抗癌传递系统的功能和血管栓塞功能的药物传递体。
根据这种需求,本发明的发明人曾开发了解决以往的癌症局部治疗用微珠存在的问题的白蛋白/右旋糖酐硫酸酯微珠(韩国专利申请第10-2013-0139303号)及白蛋白/糖胺聚糖微珠(韩国专利申请第10-2013-0139304号)。上述微珠是由生物相容性材料的白蛋白和阴离子性高分子制备而成,因此当适用于人体时具有安全性,由此可以有效闭塞向肝肿瘤供给营养的血管的同时,并且释放吸附在微珠的表面的抗癌剂,因此可有效控制肿瘤的生长。
另一方面,每个微珠的化疗栓塞用微珠的药物洗脱特性具有差异,目前因缺乏临床结果,因而实际情况为,对于洗脱速度快为有效还是洗脱速度慢为有效的统计结果还欠妥。进而,理所当然地需要有关肿瘤的大小及癌肿的发展程度的药物的释放速度的调节。
在本发明的说明书全文中,参照了大量的论文及专利文献,并标记了其引用。被引用的论文及专利文献的公开内容是以全文的形式作为参照来插入于本发明的说明书中,由此更加明确地说明了本发明所属的技术领域的水平及本发明的内容。
技术实现要素:
技术问题
本发明的发明人致力于为了开发可根据微珠的使用环境和使用目的等有效地调节从化疗栓塞用微珠中释放的药物的释放速度的技术开发的研究。其结果,本发明的发明人发现白蛋白/右旋糖酐硫酸酯的微珠的药物释放特性与白蛋白/糖胺聚糖的微珠的药物释放特性不同,由此确认到当将两个微珠以特定比例来混合使用时,可根据混合比例调节药物的释放速度的事实,并完成了本发明。
因此,本发明的目的在于提供包含上述两种微珠的化疗栓塞用组合物。
本发明的再一目的在于提供用于制备化疗栓塞用组合物的上述两种微珠的用途。
本发明的另一目的在于提供上述化疗栓塞用组合物的制备方法。
本发明的还一目的在于提供通过将表面吸附有抗癌剂的上述两种微珠进行给药来治疗癌症的方法。
本发明的又一目的及优点可以根据如下的发明的详细的说明、发明要求保护范围及附图更加明确。
解决问题的方案
根据本发明一实施方式,本发明提供化疗栓塞用组合物,上述化疗栓塞用组合物的特征在于,包含第一生物降解性微珠及第二生物降解性微珠,上述第一生物降解性微珠包含通过交联结合来形成微珠形态的白蛋白以及作为包含在上述白蛋白的交联物内的阴离子性高分子的右旋糖酐硫酸酯,上述第二生物降解性微珠包含通过交联结合来形成微珠形态的白蛋白以及作为包含在上述白蛋白交联物内阴离子性高分子的糖胺聚糖(glycosaminoglycan)类高分子,上述第一生物降解性微珠及第二生物降解性微珠能够通过包含在上述第一生物降解性微珠及第二生物降解性微珠中的阴离子性高分子的静电引力,在微珠表面上吸附抗癌剂。
根据本发明另一实施方式,本发明提供用于制备上述化疗栓塞用组合物的上述第一生物降解性微珠及第二生物降解性微珠的用途。
本发明的发明人致力于为了开发可根据微珠的使用环境和使用目的等有效地调节从化疗栓塞用微珠中释放的药物的释放速度的技术开发的研究。其结果,本发明的发明人发现白蛋白/右旋糖酐硫酸酯的微珠的药物释放特性与白蛋白/糖胺聚糖的微珠的药物释放特性不同,由此确认到了当将两个微珠以特定比例来混合使用时,可根据混合比例调节药物的释放速度的事实。
根据本发明一实施例,当向体内将包含有第一生物降解性微珠及第二生物降解性微珠的本发明的组合物进行给药时,可向周围释放抗癌剂,此时的抗癌剂的释放速度根据包含在组合物中的第一生物降解性微珠及第二生物降解性微珠的配合比例发生变化。
如通过下述实施例得到的确认所示,白蛋白/右旋糖酐硫酸酯微珠(第一生物降解性微珠)的抗癌剂的释放速度显著慢于白蛋白/糖胺聚糖微珠(第二生物降解性微珠),在混合这些微珠的情况下,根据混合比例表示出了各不相同的抗癌剂的释放特征(洗脱特性)(参照图6至图10)。因此,可以通过调节第一生物降解性微珠及第二生物降解性微珠的混合比例,来调节组合物所表示出的抗癌剂的释放速度(洗脱速度)。
根据本发明一实施例,包含在本发明的组合物的第一生物降解性微珠与第二生物降解性微珠的比例为0.01~99.99︰99.99~0.01(v/v%)。
根据本发明一实施例,本发明的组合物示出的抗癌剂的释放速度,可以根据对于第一生物降解性微珠的第二生物降解性微珠的比例增加而加快。
本发明的化疗栓塞用组合物是为了治疗实体癌而注射在体内来的。作为一例,本发明的组合物是为了肝癌的化疗栓塞术(肝动脉栓塞术)而向体内进行给药。除了肝癌之外可适用的实体癌可例举为通过直肠动脉来治疗直肠细胞癌的方法(K.Tsuchiya,Urology.Apr;55(4):495-500(2000))。
根据本发明一实施例,本发明的组合物能够以将第一生物降解性微珠及第二生物降解性微珠包装在适当的容器(例如,样品瓶)内的方式实现。上述生物降解性微珠可以同溶液一起包装在样品瓶(湿式),并且可以将生物降解性微珠形成粉末状态来包装在样品瓶(干式)。并且,上述第一生物降解性微珠及第二生物降解性微珠能够以混合于容器内的状态来存在,也可以在选择性地额外划分的空间独立存在。
以下,对上述第一生物降解性微珠及第二生物降解性微珠进行详细的说明。有关上述微珠的说明还分别记载于韩国专利申请第10-2013-0139303号及第10-2013-0139304号,上述专利文献作为参照来插入于本发明的说明书中。
作为上述第一生物降解性微珠的组成成分包含白蛋白及右旋糖酐硫酸酯。上述白蛋白起到支撑体的作用,即,通过交联结合来形成微珠的形态并保持。上述右旋糖酐硫酸酯作为阴离子性高分子,其作用在于,通过包含在进行交联结合的白蛋白内,来使抗癌剂吸附于微珠表面。上述白蛋白及右旋糖酐硫酸酯均作为生物相容性高分子,可以在体内进行分解,因此可以解决因以往的聚乙烯醇的微珠所存在的无法在体内进行分解而产生的问题,例如,因聚乙烯醇以非特定的方式扩散于体内而引起炎症,或者因沿着血管扩散至其他脏器而有可能引起脑血栓等的问题。
上述第二生物降解性微珠作为组合成分包含白蛋白及糖胺聚糖类高分子。上述白蛋白与第一生物降解性微珠相同地起到支撑体的作用,即,通过交联结合来形成微珠的形态并保持。上述糖胺聚糖类高分子作为阴离子性高分子,其作用在于,通过包含在进行交联的白蛋白内,来使抗癌剂吸附于微珠表面。上述白蛋白及糖胺聚糖类高分子均作为生物相容性高分子物质,可以在体内进行分解,因此与上述第一生物降解性微珠相同地,可以解决因以往的聚乙烯醇的微珠所存在的无法在体内进行分解而产生的问题,例如,因聚乙烯醇因以非特定的方式扩散于体内而引起炎症,或者因沿着血管扩散至其他脏器,而有可能引起脑血栓等的问题。
根据本发明一实施例,上述第一生物降解性微和/或第二生物降解性微珠的阴离子性高分子与进行交联结合的白蛋白进行酰胺结合。在这种情况下,上述白蛋白与阴离子性高分子的羧基或氨基形成酰胺结合,并且白蛋白之间进行交联结合,来起到形成微珠的形态并保持的支撑体的作用。上述阴离子性高分子通过与白蛋白的氨基或羧基来形成酰胺结合使抗癌剂吸附于微珠的表面。
根据本发明一实施例,上述第二生物降解性微珠包含通过进行交联结合的白蛋白与阴离子性高分子的糖胺聚糖类高分子形成酰胺结合,来形成的白蛋白-糖胺聚糖的结合物。
在本发明的说明书中所使用的术语“生物降解性”是指,当露出在生理溶液(physiological solution)时可被分解的性质,例如,在包括人类的哺乳动物的体内,可被体液或微生物等分解的性质。
根据本发明一实施例,上述白蛋白作为广泛分布于体细胞或体液中的蛋白质,包含动物白蛋白及植物白蛋白。
根据一特定例,上述动物白蛋白包含卵清白蛋白、血清白蛋白、乳白蛋白及肌浆蛋白,上述植物白蛋白包含麦清蛋白(大麦种子)、豆白蛋白(豌豆)及赖氨酸(蓖麻种子)。在上述白蛋白中也包含白蛋白的变异体。
根据本发明一实施例,上述糖胺聚糖类高分子选自由硫酸软骨素(chondroitin sulfate)、硫酸皮肤素(dermatan sulfate)、硫酸角质素(keratan sulfate)、硫酸乙酰肝素(heparan sulfate)、肝素(heparin)及透明质酸(hyaluronan)组成的组。
根据本发明一实施例,上述白蛋白的交联通过热交联或醛类交联来进行。
根据一特定例,上述醛类交联剂选自由戊二醛、甲醛、二醛淀粉、琥珀酸醛、丙烯醛、草酸醛、2-甲基丙烯酸醛及2-氧代丙醛组成的组。
根据本发明一实施例,上述第一生物降解性微珠及第二生物降解性微珠的每1ml微珠可分别吸附10~100mg的抗癌剂。
根据一特定例,作为上述生物降解性微珠的抗癌剂的吸附能力为每1ml微珠吸附20~60mg,在再一特定例中,每1ml微珠吸附20~55mg,在还一特定例中,每1ml微珠吸附20~50mg。
根据本发明一实施例,上述第一生物降解性微珠及第二生物降解性微珠还包含利用与阴离子性高分子之间的静电引力而吸附于在微珠表面的抗癌剂。
根据一特定例,上述抗癌剂为蒽环类抗癌剂。上述蒽环类抗癌剂具有,例如,阿霉素、柔红霉素、表阿霉素、含去甲氧柔红霉素、吉西他滨、米托蒽醌、吡柔比星及戊柔比星等。
根据其他特定例,上述抗癌剂为伊立替康。
根据本发明的另一实施方式,本发明提供包括如下的步骤的化疗栓塞用组合物的制备方法,上述化疗栓塞用组合物的制备方法包括:步骤(a),通过对微尺寸的泡沫进行交联,使白蛋白进行交联结合,来制备在上述白蛋白交联物内包含有右旋糖酐硫酸酯的第一生物降解性微珠,上述微尺寸的泡沫是通过对溶解有白蛋白和作为阴离子性高分子的右旋糖酐硫酸酯的微珠制备用溶液进行乳化而形成的;步骤(b),通过对微尺寸的泡沫进行交联,使白蛋白进行交联结合,来制备在上述白蛋白交联物内包含有糖胺聚糖类高分子的第二生物降解性微珠,上述微尺寸的泡沫是通过对溶解有白蛋白和作为阴离子性高分子的右旋糖酐硫酸酯的微珠制备用溶液进行乳化而形成的;以及步骤(c),以规定比例对上述第一生物降解性微珠及第二生物降解性微珠进行混合之后包装在容器中,根据上述第一生物降解性微珠及第二生物降解性微珠的配合比例来调节化疗栓塞用组合物的抗癌剂释放速度。
根据本发明一实施例,本发明的方法还包括在步骤(a)和/或步骤(b)之后使制备的第一生物降解性微珠及第二生物降解性微珠与抗癌剂相接触,并利用微珠的阴离子性高分子的静电引力使抗癌剂吸附于微珠表面的步骤。
根据本发明的另一实施例,本发明的方法还包括在步骤(c)之后使包装在容器的第一生物降解性微珠及第二生物降解性微珠与抗癌剂相接触,并利用微珠的阴离子性高分子的静电引力,使抗癌剂吸附于微珠表面的步骤。此时,抗癌剂的吸附可以在上述生物降解性微珠被包装在容器内的状态下实施,或者可以从容器中拿出微珠之后,在另外的容器中实施。
根据本发明一实施例,上述步骤(a)及步骤(b)的微珠制备用溶液的乳化为利用包含天然油或增粘剂的有机溶剂来实施。
作为可利用的天然油的例,可以举出中链甘油三酯(medium cha in triglyceride,MCT)、棉子油、玉米油、杏仁油、杏油、鳄梨油、巴巴苏油、椰子油、春黄菊油、芥花油、可可脂、椰子油、鱼肝油、咖啡油、鱼油、亚麻籽油、霍霍巴油、葫芦油、葡萄籽油、榛子油、薰衣草油、柠檬油、芒果籽油、橙油、橄榄油、貂油、棕榈树油、迷迭香油、芝麻油、牛油果油、豆油、向日葵油及核桃油等。
作为可利用的有机溶剂,可以举出丙酮、乙醇、醋酸丁酯等。上述有机溶剂为了赋予适当的粘度而包含增粘剂。作为上述增粘剂的例,可以举出羟甲基纤维素、羟丙基甲基纤维素、乙酸丁酸纤维素等的纤维素类聚合物。
根据本发明一实施例,上述步骤(a)及步骤(b)的微尺寸的泡沫是利用微流体系统或封装物而形成的。微流体系统作为利用微观结构的碎片来制备微珠的方法,在大的管的内部放置更小的管之后,若在反方向上流入水和油,则借助相互之间的张力而形成微珠。即,若将微珠制备用溶液用作内部的流体,且将上述天然油或有机溶剂(收集溶液)用作外部流体来流入,则借助张力形成微珠之后,将它再次收集在收集溶液中,并可通过交联反应来制备微珠。
封装物的特征在于,利用类似于静电纺丝的方法,在喷嘴与收集溶液之间形成电磁场之后,将借助张力来形成的水珠精细分裂成具有细小尺寸的微珠。将微珠制备用溶液转移到合适容量的注射器,将此安装在注射器泵之后与封装物相连接。并且,也将收集溶液转移到适合于容量的盘子之后,放置在搅拌器的上部,并适当地设定封装物的环境之后,在收集溶液中喷射微珠制备用溶液来形成泡沫。封装物的适用条件为如下:流速为1~5ml/分钟,施加电力为1000~3000V,超声波为2000~6000Hz,旋转数为100rpm以下,所使用的释放喷嘴的大小应该根据需要制备的微珠的大小来选择。
根据本发明另一实施例,本发明的步骤(a)及步骤(b)的微尺寸的泡沫可以利用混合微珠制备用溶液与收集溶液之后,根据适当的旋转数来进行搅拌的乳化法来制备。此时,微珠的大小取决于旋转数和搅拌时间。当形成适当大小的泡沫时,通过对泡沫进行交联来形成微珠。
根据本发明一实施例,继续搅拌来保持反应,直到白蛋白的交联反应结束为止,当反应结束时,为了清洁收集溶液而利用过量的丙酮或乙醇,来多次清洗微珠。
根据本发明一实施例,上述交联利用醛类交联剂,或者热交联的方法来进行。在利用热交联来制备本发明的微珠的情况下,由于不使用对体内有害的化学交联剂,因而在身体适宜性上优秀,而且可以省略化学交联剂的去除工序而具有经济性。
根据本发明一实施例,上述热交联的温度为60℃以上(例如,60~160℃),进行热交联的时间为1至4小时。
根据本发明一实施例,上述步骤(b)的微珠制备用溶液包含白蛋白与糖胺聚糖类高分子形成酰胺结合的白蛋白-糖胺聚糖结合物。在这种情况下,在步骤(b)中,通过交联微尺寸的泡沫,来制备形成交联的白蛋白的第二生物降解性微珠,上述微尺寸的泡沫是通过乳化由白蛋白和糖胺聚糖类高分子的酰胺结合而形成的白蛋白-糖胺聚糖结合物而形成的。由此,制备包含由形成交联的白蛋白与糖胺聚糖类高分子的酰胺结合而形成的白蛋白-糖胺聚糖结合物的第二生物降解性微珠。
在上述步骤(c)中,为了体现化疗栓塞用组合物所要达到的抗癌剂的释放速度,将第一生物降解性微珠及第二生物降解性微以规定比例来混合,并包装在容器(例如,样品瓶)。此时,以100%(v/v)为基准,上述第一生物降解性微珠和第二生物降解性微珠的混合比例可以为0.01~99.99︰99.99~0.01(v/v%)范围。
根据本发明另一实施方式,本发明提供癌症的治疗方法,其特征在于,包括将包含第一生物降解性微珠及第二生物降解性微珠的组合物向需要它的患者进行给药的步骤,上述第一生物降解性微珠包含通过交联结合来形成微珠形态的白蛋白以及作为包含在上述白蛋白交联物内的阴离子性高分子的右旋糖酐硫酸酯,上述第二生物降解性微珠包含通过交联结合来形成微珠形态的白蛋白以及作为包含在上述白蛋白交联物内的阴离子性高分子的糖胺聚糖类高分子,通过包含在上述第一生物降解性微珠及第二生物降解性微珠中的阴离子性高分子的静电引力,在上述第一生物降解性微珠及第二生物降解性微珠的表面吸附有抗癌剂。
根据本发明,可以通过将上述组合物向癌症患者进行给药之后,利用化学栓塞来治疗癌肿。
根据本发明一实施例,上述患者为肝癌患者,将上述微珠注射到患者的肝动脉。
发明的效果
以下,对本发明的特征及优点进行概括。
(ⅰ)本发明提供包含具有不同的抗癌剂的释放特征的两种生物降解性微珠的化疗栓塞用组合物及其制备方法。
(ⅱ)根据本发明,可通过调节第一生物降解性微珠及第二生物降解性微珠的配合比例,来有效地制备体现所需的抗癌剂的释放特性的化疗栓塞用组合物。
(ⅲ)因此,本发明可以有效地应用于肝癌的化疗栓塞术。
附图说明
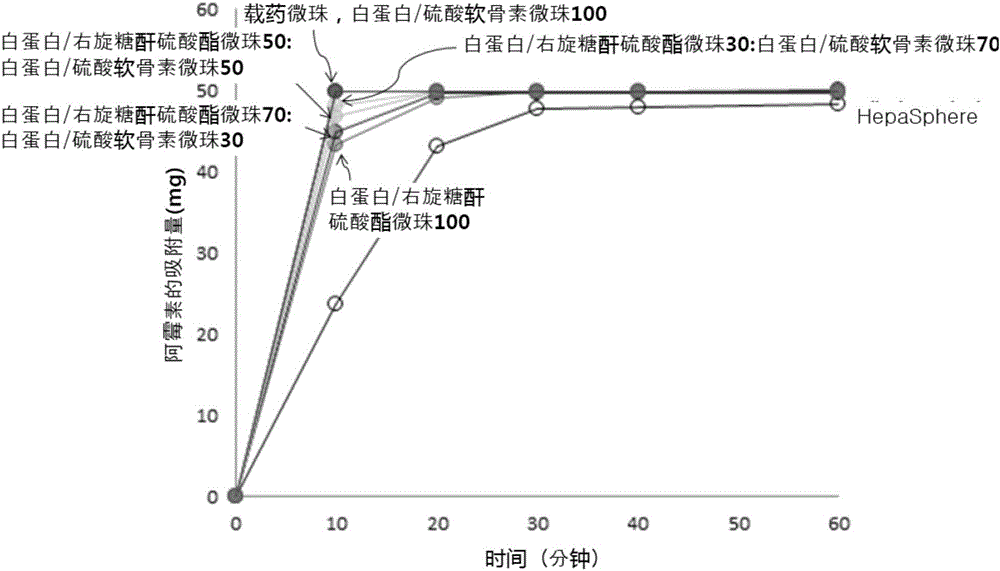
图1为按时间段示出白蛋白/右旋糖酐硫酸酯微珠(白硫葡)、白蛋白/硫酸软骨素微珠(白硫软)、它们的混合微珠及销售中的载药微珠(DC-BEAD)和作为肝癌治疗剂的HpaSphere的抗癌剂的吸附量的曲线图。
图2为按时间段示出白蛋白/右旋糖酐硫酸酯微珠(白硫葡)、白蛋白/硫酸皮肤素微珠(白硫皮)、它们的混合微珠及销售中的载药微珠和作为肝癌治疗剂的HpaSphere的抗癌剂的吸附量的曲线图。
图3为按时间段示出白蛋白/右旋糖酐硫酸酯微珠(白硫葡)、白蛋白/硫酸角质素微珠(白硫角)、它们的混合微珠及销售中的载药微珠和作为肝癌治疗剂的HpaSphere的抗癌剂的吸附量的曲线图。
图4为按时间段示出白蛋白/右旋糖酐硫酸酯微珠(白硫葡)、白蛋白/硫酸乙酰肝素微珠(白硫乙)、它们的混合微珠及销售中的载药微珠和作为肝癌治疗剂的HpaSphere的抗癌剂的吸附量的曲线图。
图5为按时间段示出白蛋白/右旋糖酐硫酸酯微珠(白硫葡)、白蛋白/肝素微珠(白肝)、它们的混合微珠及在上市销售中的载药微珠和作为肝癌治疗剂的HpaSphere的抗癌剂的吸附量的曲线图。
图6为按时间段示出白蛋白/右旋糖酐硫酸酯微珠(白硫葡)、白蛋白/硫酸软骨素微珠(白硫软)、它们的混合微珠及销售中的载药微珠和作为肝癌治疗剂的HpaSphere的抗癌剂的吸附量的曲线图。
图7为按时间段示出白蛋白/右旋糖酐硫酸酯微珠(白硫葡)、白蛋白/硫酸皮肤素微珠(白硫皮)、它们的混合微珠及销售中的载药微珠和作为肝癌治疗剂的HpaSphere的抗癌剂的吸附量的曲线图。
图8为按时间段示出白蛋白/右旋糖酐硫酸酯微珠(白硫葡)、白蛋白/硫酸角质素微珠(白硫角)、它们的混合微珠及在上市销售中的载药微珠和作为肝癌治疗剂的HpaSphere的抗癌剂的吸附量的曲线图。
图9为按时间段示出白蛋白/右旋糖酐硫酸酯微珠(白硫葡)、白蛋白/硫酸乙酰肝素微珠(白硫乙)、它们的混合微珠及销售中的载药微珠和作为肝癌治疗剂的HpaSphere的抗癌剂的吸附量的曲线图。
图10为按时间段示出白蛋白/右旋糖酐硫酸酯微珠(白硫葡)、白蛋白/肝素微珠(白肝)、它们的混合微珠及销售中的载药微珠和作为肝癌治疗剂的HpaSphere的抗癌剂的吸附量的曲线图。
具体实施方式
以下,利用实施例对本发明进行更详细的说明。这些实施例仅用于更详细地说明本发明,并且根据本发明的要旨,本发明的范围并不局限于这些实施例,这对于本发明所属技术领域的普通技术人员是显而易见的。
实施例
制备例1.白蛋白/右旋糖酐硫酸酯微珠的制备
白蛋白通过交联结合来形成微珠的形态,根据如下的方法来制备了在上述白蛋白交联物内包含有右旋糖酐硫酸酯的微珠。用于制备微珠的白蛋白及阴离子性高分子的组成为如下列表1所示。
表1
利用封装物来制备了上述的组成1~5的微粒,并且制备条件为如下:流速为1~5ml/分钟,施加电力为1000~3000V,超声波为2000~6000Hz,旋转数为100rpm以下。所使用的释放喷嘴的大小是根据需要制备的微珠的大小来选择的。将微珠制备用溶液转移到合适容量的注射器之后,将此安装在注射器泵之后,与封装物(B-390,BUCHI)相连接,并且,将收集溶液转移到合适容量的盘子上之后,放置在搅拌器的上部。设定封装物的环境之后,在收集溶液喷射微珠制备溶液,并且将收集溶液加热至80~120℃,来形成热交联,由此形成了微珠。交联时间为2~6小时,作为收集溶液使用了包含溶解有10%的乙酸丁酸纤维素(cellulose acetate butyrate)的n-醋酸丁酯或羟丙基甲基纤维素的丙酮。在以下的实施例1中使用了组合1的白蛋白/右旋糖酐硫酸酯微珠。
制备例2.白蛋白/糖胺聚糖微珠的制备
为了白蛋白的氨基(NH2-)和作为阴离子性高分子的糖胺聚糖的羧基(COOH-)形成酰胺结合,而使用了氰基硼氢化钠(sodium cyano borohydride,SCBH)或氯化1-乙基-(3-二甲基氨基丙基)碳酰二亚胺(1-Ethyl-3-(3-dimethylamino-propyl)carbodiimide,EDC)/N-羟基丁二酰亚胺(N-Hydroxysuccini mide,NHS)。首先,利用氰基硼氢化钠或1-乙基-(3-二甲基氨基丙基)碳酰二亚胺/N-羟基丁二酰亚胺来活化了阴离子性高分子之后,如下列表2的组合1~5,通过与白蛋白的反应来形成了结合。之后,将此透析1~2天,去除未反应物之后,取得了微珠制备用溶液。
表2
利用封装物来制备了上述的组合1~5的微粒,并且制备条件为如下:流速为1~5ml/分钟,施加电力为1000~3000V,超声波为2000~6000Hz,旋转数为100rpm以下。所使用的释放喷嘴的大小是根据需要制备的微珠的大小来选择的。将微珠制备用溶液转移到合适容量的注射器之后,将此安装在注射器泵之后,与封装物(B-390,BUCHI)相连接,并且,将收集溶液转移到合适容量的盘子上之后,放置在搅拌器的上部。设定封装物的环境之后,在收集溶液喷射微珠制备溶液,并且将收集溶液加热至80~120℃,来形成热交联,由此形成了微珠。交联时间为2~6小时,作为收集溶液使用了包含溶解有10%的乙酸丁酸纤维素(cellulose acetate butyrate)的n-醋酸丁酯或羟丙基甲基纤维素的丙酮。在以下的实施例1中使用了组合1的白蛋白/右旋糖酐硫酸酯微珠。
实施例1.肝动脉化疗栓塞用微珠的混合
在上述制备例1中所制备的白蛋白/右旋糖酐硫酸酯微珠载入速度慢于在制备例2中所制备的白蛋白/糖胺聚糖微珠,而且药物的洗脱速度也慢于在制备例2中所制备的白蛋白/糖胺聚糖微珠。由此,本发明的发明人试图通过调节这些微珠的配合比例,来调节吸附在这些微珠的药物的释放速度。在下列表3中示出了混合微珠的组合。
表3
实施例2.阿霉素的吸附实验
按照如下的方式进行了阿霉素的吸附实验。首先,将50mg的阿霉素溶解于2ml的蒸馏水。按照配合比例正确测量2ml的微珠(白蛋白/右旋糖酐硫酸酯微珠、白蛋白/葡萄糖胺聚糖微珠、它们的混合微珠、载药微珠或作为肝癌治疗剂的HpaSphere),并放入阿霉素溶液之后混合。将这些放置于常温状态,在10、20、30、40及60分钟的时间段取出上清液之后用高效液相色谱法(High Performance Liquid Chrom atography,HPLC)进行了分析。可以通过与预先制作的校准曲线之间的对比,来计算出从50mg/2ml的阿霉素溶液中被排出的阿霉素的量,并且该值是阿霉素吸附于微珠的量。
在图1至图5中示出了实验结果。如附图中所示,作为肝癌治疗剂的HpaSphere的阿霉素的吸附时间长于其他微珠,相反,剩余微珠以类似的状态来吸附了阿霉素(图1至图5)。
实施例3.阿霉素的洗脱实验
为了确认药物的洗脱行为,利用洗脱器进行了洗脱实验。实验方法为如下。将通过阿霉素的吸附实验载入有50mg的药物的2ml的微珠(白蛋白/右旋糖酐硫酸酯微珠、白蛋白/葡萄糖胺聚糖微珠、这些的混合微珠、载药微珠或作为肝癌治疗剂的HpaSphere)放入装有500ml的洗脱液(PBS,pH 7.4)的玻璃容器之后,在37℃中温育,并以50rpm的速度搅拌。无需更换洗脱液可继续使用,并在10、20、30、40、60、90及120分钟的时间段取出上清液之后,利用高效液相色谱法来进行了分析。
在图6至图10中示出了洗脱结果。如附图中所示,各微珠的抗癌剂的洗脱特性互不相同。尤其,示出了如下的状态,即,白蛋白/右旋糖酐硫酸酯微珠的抗癌剂的洗脱速度显著慢于白蛋白/葡萄糖胺聚糖微珠,在白蛋白/右旋糖酐硫酸酯微珠上混合白蛋白/葡萄糖胺聚糖微珠的混合微珠的情况下,根据白蛋白/葡萄糖胺聚糖微珠的混合比例的增加,洗脱速度也增加(图6至图10)。
从这些结果中可见,通过调节白蛋白/右旋糖酐硫酸酯微珠和白蛋白/糖胺聚糖微珠的混合比例,可以自由调节抗癌剂的释放速度。
以上,详细地叙述了本发明的特定部分,对于本发明所属技术领域的普通技术人员可以明确的是,这些具体的技术只是优选的实施例之一,而不是限定本发明的范围。因此,本发明的实际范围是按照附加的发明要求保护范围和该等同物而定义。
- 还没有人留言评论。精彩留言会获得点赞!