用于治疗胰腺癌的基于肽的方法与流程
相关申请数据
本文中引用的每个申请和专利以及每个申请和专利中引用的每篇文件或参考文献(包括在每个发布的专利的审查期间;“申请引用的文件”),以及与这些申请和专利中的任一对应和/或要求这些申请和专利中的任一的优先权的每个pct和外国申请或专利以及在每篇申请引用的文献中引用或参考的每篇文献特此通过引用明确并入本文,并且可以在本发明的实践中采用。更一般地,本文中引用了文献或参考文献,无论是在权利要求书前的参考文件列表中,还是在文本本身中;并且这些文献或参考文献(“本文引用的参考文献”)中的每篇,以及本文引用的每篇参考文献(包括任何制造商的说明书,用法说明等)中引用的每篇文献或参考文献特此通过引用明确并入本文。
序列表数据
本文所附的序列表文本文件(于2015年10月13日创建,大小为2千字节,文件名“6137nci-38-pct_sequencelisting_st25”)通过引用整体并入本文。
背景技术:
胰腺癌是一种在胰腺组织中形成恶性(癌性)细胞的疾病。胰腺癌经常具有较差的预后,即使在早期诊断时。胰腺癌通常快速扩散,并且在其早期阶段中很少发现,这是它作为癌症死亡的首要起因的主要原因。事实上,在美国(u.s.),胰腺癌是男性和女性二者的第四大癌症死亡原因,每年超过38,000例死亡。到2020年,胰腺癌预计在美国的所有癌症相关死亡中排名第二。此外,在美国的胰腺癌的5年存活率在实体器官肿瘤中排名最低。对胰腺癌的早期检测没有可靠的筛选测试。直至胰腺癌相当晚期前可能不出现体征和症状,并且完全手术切除是不可能的。
包括手术、放射疗法和化疗在内的胰腺癌的标准治疗在很大程度上显示有限的疗效。事实上,批准的治疗,包括吉西他滨(gemcitabine)、folfirinox、吉西他滨和abraxane的组合、以及吉西他滨和厄洛替尼(erlotinib)的组合,最多可以将存活改善少数至几个月。较新的疗法尚未表明更加成功,这可能是由于胰腺中基质厚而相对缺乏丰富的血管所致。
技术实现要素:
肽a(其具有氨基酸序列lys-phe-arg-lys-ala-phe-lys-arg-phe-phe(seqidno:1))和肽b(其具有氨基酸序列phe-ala-lys-lys-phe-ala-lys-lys-phe-lys(seqidno:2))在许多炎性疾病模型中得到评估,并且在所有它们中都显示强烈的活性。
胰腺癌的独特之处在于它具有非常强的炎性成分(farrow等人2004annalsofsurgery239(6):763-771;zambirinis等人2015cancerj20(3):195-202)。它在其药物扩散/灌注要求上也是独特的,即胰腺肿瘤不容易摄取药物(whatcott等人第8章:desmoplasiaandchemoresistanceinpancreaticcancer2012pancreaticcancerandtumormicroenvironment,grippo和munshi编)。另外,已经显示了经由基质疗法的开发靶向基质可以在胰腺癌的临床前模型中产生有效的肿瘤反应(olive等人2009science324(5933):1457-61;provanzano等人2012cancercell21(3):418-29)。
在多种胰腺癌动物模型中测试肽a和肽b后,如本文所述,已经针对胰腺癌发现肽的强抗癌活性。本文还描述了与批准的化学治疗剂吉西他滨联合施用肽a或肽b,这缩小肿瘤并延长形成胰腺癌的转基因动物的寿命。因此,本公开基于在体外和体内具有强大抗炎活性的肽的发现,并且在另一方面,基于肽在循环中足够稳定(如也通过质谱测量显示,允许测定其药代动力学和剂量反应性质)的发现。
本公开提供了治疗受试者中的胰腺癌的方法,所述方法包括向受试者施用包含抗炎性肽a或肽b或其变体的药物组合物。
另一方面,本发明提供了治疗受试者中的胰腺癌的方法,所述方法包括向受试者施用包括抗炎性肽a或肽b或其变体,和至少一种化学治疗剂的药物组合物。这些方法可以包括通过向受试者施用包含氨基酸序列lys-phe-arg-lys-ala-phe-lys-arg-phe-phe(seqidno:1),或phe-ala-lys-lys-phe-ala-lys-lys-phe-lys(seqidno:2)的肽,或其多聚体、衍生物、或变体来治疗受试者中的胰腺癌。这些方法可以包括施用另外的治疗剂。另外的治疗剂可以是一种或多种化学治疗剂。此类化学治疗剂可以选自由以下组成的组:吉西他滨或免疫检查点抑制剂。化学治疗剂可以是吉西他滨abraxane或folfirinox方案(氟尿嘧啶、甲酰四氢叶酸、伊立替康、奥沙利铂)(j.clin.one.2011年10月1日,29(28):3727-3729)。
在这些方法中,施用可以通过肠胃外施用。在这些方法中,可以以约0.05至约25mg/kg的剂量施用肽。在这些方法中,受试者可以是人。
一个方面是用于治疗胰腺癌的药物组合物,其包含含有氨基酸序列lys-phe-arg-lys-ala-phe-lys-arg-phe-phe(seqidno:1)或phe-ala-lys-lys-phe-ala-lys-lys-phe-lys(seqidno:2)的肽或其多聚体、衍生物、或变体,和药学上可接受的载体。这些组合物可以包含至少一种另外的治疗剂,并且因此,另一个方面是用于治疗胰腺癌的药物组合物,其包含含有氨基酸序列lys-phe-arg-lys-ala-phe-lys-arg-phe-phe(seqidno:1)或phe-ala-lys-lys-phe-ala-lys-lys-phe-lys(seqidno:2)的肽或其多聚体、衍生物、或变体、至少一种另外的治疗剂,和药学上可接受的载体。相关方面是包含氨基酸序列lys-phe-arg-lys-ala-phe-lys-arg-phe-phe(seqidno:1)或phe-ala-lys-lys-phe-ala-lys-lys-phe-lys(seqidno:2)的肽或其多聚体、衍生物、或变体用于治疗胰腺癌的用途。
本发明的其它方面在以下公开中描述或者从以下公开看是显而易见的,并且在本发明的范围内。
附图说明
以下通过实施例给出的但不意图将本发明限于所描述的具体实施方案的详细描述可以结合附图来理解,其中:
图1a显示了随机分配到用媒介物(h2o或pbs);50mg/kg吉西他滨;20mg/kg肽a;或肽a(20mg/kg)和吉西他滨(50mg/kg)的组合处理的具有肿瘤的小鼠中肿瘤体积的相对增加。通过腹膜内注射施用所有处理。结果显示单独的肽a停止转基因动物中的胰腺癌的生长,并且肽a与吉西他滨rp-182的组合显著降低了转基因动物中胰腺癌的生长。图1b显示用三种药物和对照方案处理的转基因动物的存活率。存活曲线显示rp-182与吉西他滨组合显著改善了存活。
图2显示了胰腺癌的转基因动物模型中肽a施用(单独的和与吉西他滨组合)与其它研究药剂(也单独测试和与吉西他滨组合测试)的比较。
图3显示了在施用肽a(显示为‘rp182’)和其它已知的研究抗癌剂之后胰腺肿瘤的标准化平均肿瘤体积的百分比变化的比较。
图4显示了以存活的百分比增加相对于肿瘤体积的百分比变化的比率对在胰腺癌的转基因动物模型中与吉西他滨组合使用的肽a(肽a显示为‘rp182’)和其它研究药剂的相对益处的概括。
图5显示与随机10聚体生物素化肽比较c末端生物素化肽a的结合,证明肽a结合对p16胰腺癌细胞是特异性的。
图6显示n-和c-末端标记的肽a结合的细胞结合曲线,表明肽a经由n-末端优先结合癌细胞。
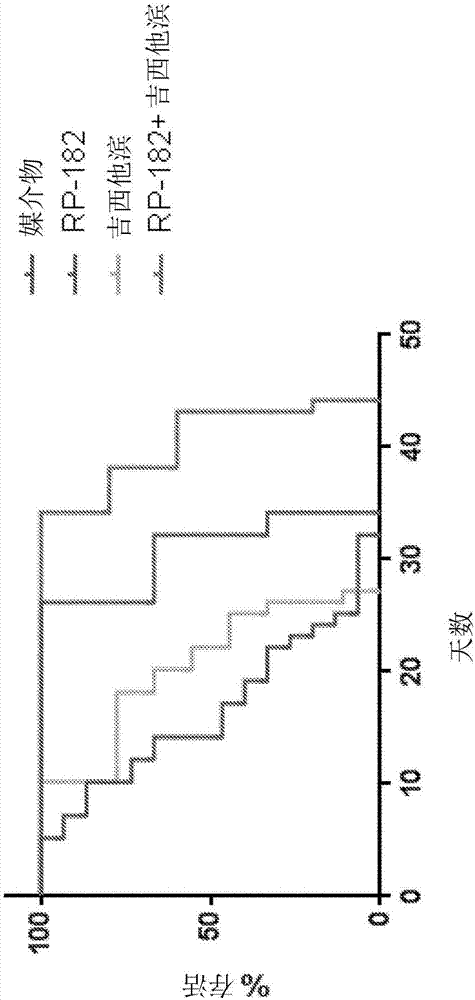
图7显示了胰腺癌异种移植模型中不同药物治疗的比较。对于媒介物相对于单独的rp-182(*),p=0.007。对于单独的吉西他滨相对于吉西他滨+rp-182(**),p<0.007。
图8显示了用肽b处理后胰腺癌中的免疫系统细胞的分析,表明肽b处理增加b细胞,并减少这些胰腺肿瘤中的巨噬细胞。
具体实施方式
如上文讨论,本文公开的本发明涉及抗炎肽,特别是具有免疫抑制性质的肽的用途,以及对患有胰腺癌或有形成胰腺癌的风险的受试者施用此类肽的方法。
定义
如本文所用,单数形式“一个/种”,“和”和“所述/该”包括复数指示物,除非上下文另有明确规定。因此,例如,提及“细胞”包括多个/种此类细胞,并且提及“蛋白质”包括提及本领域技术人员已知的一种或多种蛋白质及其等同物,等等。本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常理解的含义相同的含义,除非另有明确说明。
术语“肽”和“多肽”在本文中同义使用,是指由氨基酸残基构建的聚合物。
如本文所用,术语“条带性亲疏(striapathic)区”是指疏水性模块和亲水性模块的交替序列。“疏水性模块”由1至5个疏水性氨基酸残基组成的肽序列构成。同样,亲水性模块由1至5个亲水性氨基酸残基组成的肽序列构成。
如本文所用,例如在药物组合物的上下文中,“基本上纯的”意指肽占组合物(例如组合物的总蛋白质)的总含量的大于约50%,或总蛋白质含量的大于约80%。例如,“基本上纯的”肽是指总组合物的至少80%、至少85%、至少90%或更多是肽(例如总蛋白质的95%、98%、99%、大于99%)的组合物。肽可以占组合物中总蛋白质的大于约90%、大于约95%、大于98%或大于99%。在一些实施方案中,当肽是按重量计至少60%或至少75%不含与生产期间与其相关联的有机分子时,肽是基本上纯的。在一些实施方案中,肽是按重量计至少60%、至少75%、至少80%、至少85%、至少90%、至少95%或至少99%纯的。例如,在一些实施方案中,当免疫调节肽是按重量计至少60%或至少75%不含与生产期间与肽相关联的有机分子时,免疫调节肽是基本上纯的,在一些实施方案中,免疫调节肽是按重量计至少60%、至少75%、至少80%、至少85%、至少90%、至少95%或至少99%纯的。
如本文互换使用,术语“受试者”、“患者”和“个体”是指多细胞动物(包括哺乳动物(例如人、非人灵长类、鼠、绵羊(ovines)、牛、反刍动物、兔类动物、猪、山羊、马、犬、猫、鸟纲(ayes)等)、鸟类(例如鸡)、两栖动物(例如爪蟾)、爬行动物、和昆虫(例如果蝇)。“动物”包括豚鼠、仓鼠、白鼬、毛丝鼠、小鼠和棉鼠。
如本文所用,“肿瘤”是指所有赘生性细胞生长和增殖,无论恶性或良性,和所有癌前期和癌性细胞和组织。如本文提及,术语“癌症”、“癌性”、“细胞增殖性病症”、“增殖性病症”和“肿瘤”不是相互排斥的。
如本文所用,术语“抗炎性质”是指可以评估,和/或减少或抑制,或预期将减少或抑制由蛋白质靶标介导的促炎性信号和/或减少或抑制受试者中的炎症的多肽的任何性质。
“有效量”是指以必要的剂量且持续必要的时间段有效实现期望的治疗或防范结果的量。肽或包含本文所述的肽的药物组合物的“治疗有效量”可以随诸如个体的疾病状态、年龄、性别和体重,以及肽或组合物在个体中能够引发期望的反应等因素而变化。治疗有效量还是其中治疗有益效果超过肽或包含肽的组合物的任何毒性或不利影响的量。
本文提及任何数值范围(例如,剂量范围)都明确地包括由该范围包含的每个数值(包括分数和整数)。例如但不限于本文提及范围为0.5mg/kg至100mg/kg明确地包括两者之间的所有整数和分数。
如本文所述,称为“患有”胰腺癌的个体已被诊断患有和/或显示胰腺癌的一种或多种症状。
如本文所用,术语“有胰腺癌的风险”是指倾向于形成胰腺癌和/或表现疾病的一种或多种症状的受试者(例如人)。这种倾向可能是遗传的或由于其它因素。意图本发明不限于任何特定的体征或症状。因此,意图本发明涵盖在经历胰腺癌的从亚临床到充分形成(full-blown)的任何范围的受试者,其中受试者表现出与胰腺癌相关的至少一种适应症(例如,体征和症状)。
如本文所用,术语“治疗/处理(treat/treatment/treating)”是指用于部分或完全减轻、改善、缓解、抑制、预防疾病、病症和/或病状(例如胰腺癌)、延缓疾病、病症和/或病状(例如胰腺癌)的发作、降低疾病、病症和/或病状(例如胰腺癌)的严重性和/或减少疾病、病症和/或病状(例如胰腺癌)的一种或多种症状或特征的发生的任何方法。可以对不表现出疾病、病症和/或病状的体征的受试者施用治疗。在一些实施方案中,为了降低形成与疾病、病症和/或病状相关的病理学的风险,可以对仅表现出疾病、病症和/或病状的早期体征的受试者施用治疗。
术语“包含(comprise/comprising)”意图具有美国专利法归于它们的广义含义,并且可以意指“包括(include/including)”等。
通过参考以下详细描述和阐述性实施例,可以更全面地理解本发明,这些实施例旨在举例说明本发明的非限制性实施方案。
多肽
肽a包含具有序列lys-phe-arg-lys-ala-phe-lys-arg-phe-phe(seqidno:1)的肽、基本上由具有序列lys-phe-arg-lys-ala-phe-lys-arg-phe-phe(seqidno:1)的肽组成、或由具有序列lys-phe-arg-lys-ala-phe-lys-arg-phe-phe(seqidno:1)的肽组成。
肽b包含具有序列phe-ala-lys-lys-phe-ala-lys-lys-phe-lys(seqidno:2)的肽、基本上由具有序列phe-ala-lys-lys-phe-ala-lys-lys-phe-lys(seqidno:2)的肽组成、或由具有序列phe-ala-lys-lys-phe-ala-lys-lys-phe-lys(seqidno:2)的肽组成。
肽a和b在血清中是稳定的,并且可以通过例如(离子阱)质谱法来检测和测量。
变体多肽
本文描述的肽的“变体”是与本文公开的多肽基本上相似,并保留主题多肽的至少一种抗炎性质或抗癌症的多肽。变体可以包括本文公开的主题多肽的n末端或c末端的一个或多个氨基酸残基的缺失(即截短);在本文公开的主题多肽中的一个或多个内部位点处缺失和/或添加一个或多个氨基酸残基;和/或在本文公开的主题多肽中的一个或多个位置处的一个或多个氨基酸残基的取代。对于长度为12个氨基酸残基或更短的主题多肽,变体多肽优选包括三个或更少(例如,2个、1个或无)缺失的氨基酸残基,无论是位于内部、在n端末端和/或在c端末端。
因此,同样涵盖关于抗炎性多肽的本发明的方法和组合物,所述抗炎性多肽与本文公开的抗炎性多肽是至少50%同一的(例如,至少60%、70%、80%、90%或更多)并且保留至少一种抗炎性质。
取代的氨基酸残基可以与被替换的氨基酸残基无关(例如,在疏水性/亲水性、大小、电荷,极性等方面无关),或者取代的氨基酸残基可以构成相似的、保守的、或高度保守的氨基酸取代。如本文所用,“相似”、“保守”和“高度保守”氨基酸取代如下表所示定义。氨基酸残基取代是否相似、保守或高度保守的确定仅仅基于氨基酸残基的侧链而不是肽主链,其可以被修饰以增加肽的稳定性,如下文讨论。
选择在主题肽的上下文中的保守氨基酸取代以保持肽的活性。在一个实施方案中,变体多肽结合两种或更多种靶标(例如促炎性靶标)。更优选地,变体多肽结合3、4、5或更多种促炎性靶标。例如,变体多肽可以结合靶标的任何组合(例如nf-kbii类蛋白和人血清白蛋白(hsa))。此类结合可以基于计算机、体外或体内数据。
经修饰的多肽
在本发明的方法和组合物的上下文中也考虑到通过化学或遗传方式修饰本文所述的任何抗炎性多肽。此类修饰的实例包括用呈l或d形式的非天然氨基酸和/或天然氨基酸构建部分或完全序列的肽。例如,本文公开的任何肽及其任何变体可以呈全d形式生产。此外,可以将多肽修饰成含有与氨基酸的侧链或n-或c-末端共价连接的碳水化合物或脂质部分,如糖或脂肪酸。此外,可以修饰多肽以增加施用时的溶解度和/或半衰期。例如,已经使用聚乙二醇(peg)和相关聚合物来提高血液中蛋白质治疗剂的溶解度和半衰期。因此,可以通过peg聚合物等修饰多肽。也可以将多肽修饰成含有硫、磷、卤素、金属等。并且,氨基酸模拟物可用于产生多肽。在一个实施方案中,多肽包括氨基酸模拟物,具有增强的性质,如对降解的抗性。例如,多肽可以包括一种或多种(例如全部)肽单体。
治疗/疗法
在某些实施方案中,本发明提供了治疗(例如减轻、改善、缓解、稳定、延缓发作、抑制进展、降低严重程度和/或降低发生)和/或预防受试者中的胰腺癌或与胰腺癌相关的一种或多种症状的方法和组合物。受试者可以是人。
本发明的治疗方法包括向受试者施用包含肽a或肽b的药物组合物。在某些实施方案中,治疗方法还包括降低受试者中的炎症部位的至少一种促炎性细胞因子的表达水平和/或活性(至少10%(例如15%、20%、25%、30%、35%、40%、45%、50%或更多))。至少一种促炎性细胞因子可以选自由以下组成的组:tnfα、il-1a、il-6和il-12。在其它实施方案中,治疗方法抑制或限制受试者的潜在炎症部位的这些促炎性细胞因子中的至少一种的表达水平和/或活性的增加。
组合疗法
另外,本文公开了治疗的方法(和组合物),其中抗炎性多肽(或包含此类多肽的药物组合物)可以与目前已知或稍后发现在治疗胰腺癌中有效的至少一种其它药物或疗法组合施用。在一个实施方案中,药物是化学治疗剂。在另一个实施方案中,化学治疗药物选自由以下组成的组:烷化剂、抗代谢物/核苷类似物(例如5-氟尿嘧啶、6-巯嘌呤、卡培他滨、阿糖胞苷、氟尿嘧啶、氟达拉滨、吉西他滨、羟尿酸、甲氨蝶呤、培美曲塞等)、抗肿瘤抗生素和肽抗生素,包括蒽环类抗生素(例如柔红霉素、多柔比星、表柔比星、依达比星(idarucicin)等)、放线菌素d、博来霉素、丝裂霉素-c、米托蒽醌等,拓扑异构酶抑制剂(例如,依托泊苷、替尼泊苷、米托蒽醌等)、有丝分裂抑制剂(例如紫杉烷类、埃博霉素、长春花生物碱、雌莫司汀等)、皮质类固醇(例如泼尼松、甲泼尼龙、地塞米松等)、细胞骨架破坏剂/紫杉烷类、埃博霉素、组蛋白脱乙酰酶抑制剂、激酶抑制剂、基于铂的药剂、类维生素a(retinoids)、长春花生物碱(和衍生物)、以及其它药剂,包括酶(例如l-天冬酰胺酶)、蛋白酶体抑制剂(例如硼替佐米)、治疗性癌症疫苗、单克隆抗体(包括肿瘤特异性单克隆抗体)、细胞因子(例如il-2和ifn-α)、和免疫检查点抑制剂如抗ctla4或抗-pd-1和抗-pd-1l药剂。
免疫系统依赖于多个检查点以避免健康细胞上免疫系统的过度激活,并且肿瘤细胞经常利用这些检查点以逃避免疫系统的检测。ctla-4(显示在某些癌症中异常上调并且存在于t细胞的表面上)和pd-1(也在某些肿瘤中上调并且发现抑制t细胞功能)是已经研究作为癌症疗法的靶标并且可以发现在胰腺癌中有效的检查点(pardoll,d.m.2012natrevcancer12(4):252-264;sharma等人2011natrevcancer11(11):805-812)。
考虑的疗法包括手术(如果胰腺癌局限于胰腺;如果位于胰腺头部,则是whipple手术(胰十二指肠切除术);如果在胰腺尾部和主体中,则手术除去胰腺尾部或尾巴和主体的小部分(胰脏末端切除术));放射疗法(使用诸如x射线的高能束来破坏癌细胞);化疗(注射到静脉中或口服;可以是一种化疗药物或化疗药物的组合);化疗联合放射疗法(放化疗);靶向疗法(使用攻击癌细胞内特定异常的药物;例如,厄洛替尼阻断对癌细胞发出信号以生长和分裂的化学物质);抗体疗法;基因疗法。
抗炎性多肽可以在施用另外的药物和/或疗法之前、同时或之后施用。在一个实施方案中,本发明的方法包括评估治疗性处理的功效的步骤。功效的此类评估可以基于大量的评估结果,包括但不限于组织炎症的减少、抑制或减少组织和/或血清中的炎症介质如il-1、il-6、il-12和tnf的过量产生(数据未显示)、炎性细胞因子水平(例如,血清中)的降低等。根据所评估的功效水平,可以根据需要向上调节或向下调节抗炎性多肽的剂量。
因此,通过“组合”,并不意图暗示肽和另外的药剂或疗法必须同时施用或配制用于一起递送,尽管这些递送方法在发明的范围内。此外,应当理解,组合利用的治疗活性剂可以在单一组合物中一起施用,或者在不同组合物中分开施用。一般地,每种药剂将以一定剂量和/或对所述药剂确定的时间表进行施用。
一般地,每种药剂(在此上下文下,“药剂”之一是本公开的组合物)将以对该药剂确定的剂量和时间表施用。另外,本发明包括组合物与可以改善其生物利用度、减少或修饰其代谢、抑制其排泄或修饰其在体内的分布的药剂联合递送。
联合方案中采用的疗法(例如治疗剂或手术)的具体组合将考虑期望的治疗剂和/或手术和要实现的期望的治疗效果的相容性。一般地,预期联合利用的药剂的利用水平不会超过其单独利用的水平。在一些实施方案中,联合利用的水平将低于单独利用的水平。
诊断
在一个实施方案中,本发明的治疗方法另外包括诊断患有胰腺癌的受试者或在治疗期间诊断治疗方法的功效。胰腺癌可以通过以下方式诊断:i)成像测试(可视化内脏,包括胰腺;例如超声、计算机断层摄影术(ct)扫描和磁共振成像(mri));ii)使用来自腹部内部的内窥镜超声(eus)的胰腺的超声图像;iii)血液测试(以测试由胰腺癌细胞脱落的特定蛋白质(包括肿瘤标志物));iv)腹腔镜检查(胰腺的手术可视化);iv)内窥镜逆行胰胆管造影术(ercp);v)活组织检查(例如,经由细针抽吸或在ercp期间)以从胰腺中取出组织的小样品,用于在显微镜下检查;和/或vi)经皮经肝胆管造影术(ptc)。
用于治疗胰腺癌的组合物和施用
用于治疗本公开的胰腺癌的组合物可以根据本领域已知的并在文献中广泛描述的任何常规方法来配制。因此,活性成分(例如,肽a或肽b或其变体)可以任选地与其它活性物质,适于组合物的特定用途的一种或多种常规药学上可接受的媒介物、稀释剂和/或赋形剂等一起掺入,以制备适于或可适于施用的常规制剂。根据意图的施用模式和治疗应用,它们可以配制成液体、半固体或固体、液体溶液、分散体、悬浮液等。在一些实施方案中,本发明的组合物以可注射或不溶解的溶液的形式制备。
本公开的用于治疗胰腺癌的组合物可以包括载体蛋白,如血清白蛋白(例如has、bsa等)。可以纯化或重组产生血清白蛋白。通过将药物组合物中的抗炎性多肽与血清白蛋白混合,抗炎性多肽可以有效地“负载”到血清白蛋白上,允许更大量的抗炎性多肽成功地递送到炎症部位。
本公开的治疗胰腺癌的方法可包括经由多种途径中的任一种途径施用,包括静脉内(iv)、肌内(im)、动脉内、髓内、鞘内、皮下(sq)、心室内、经皮、皮间(interdermal)、皮内、通过气管内滴注、支气管滴注和/或吸入;作为鼻喷雾剂,和/或气雾剂,和/或通过门静脉导管。在某些实施方案中,可以使用静脉内注射或输注。可以使用任何适当的施用部位。例如,本发明的组合物可以局部施用以及直接在需要作用的部位施用或可以与实体附着或以其它方式缔合,例如缀合,所述实体将有助于靶向到身体中的适当位置。
在可用于治疗胰腺癌的这些组合物中,可以使用任何生理相容的载体、赋形剂、稀释剂、缓冲液或稳定剂。合适的载体、赋形剂、稀释剂、缓冲剂和稳定剂的实例包括下列一种或多种:水、盐水、磷酸盐缓冲盐水、葡萄糖、甘油、乙醇等,以及其组合。在一些情况下,可以包括等张剂,例如糖、多元醇(例如甘露醇、山梨糖醇)或氯化钠。在某些实施方案中,可以配制本发明的组合物,以便在通过采用本领域中公知的手术向受试者施用后提供活性成分(肽a、肽b或其变体和/或另外的药物)的快速、持续或延迟释放。如上所述,在某些实施方案中,组合物呈适于注射的形式,并且合适的载体可以以任何合适的浓度存在,但示例性浓度为1%至20%或5%至10%。
治疗组合物通常在制造和储存条件下必须是无菌和稳定的。实现此类无菌性和稳定性的适当方式是本领域公知和描述的。
药物组合物通常以单位剂型配制,以便于施用和剂量的均一性。然而,应当理解,本发明的组合物的总每日(或其它)用法将由主治医师在合理的医学判断范围内决定。任何特定受试者的特定治疗有效剂量水平将取决于多种因素,包括采用的组合物的活性;施用后组合物的半衰期;受试者的年龄、体重、一般健康、性别和饮食;施用时间、施用途径和肽a和(如果使用的话)采用的另外的治疗剂的排泄速率;治疗的持续时间;与采用的具体化合物联合或同时使用的药物;和医学领域中公知的类似因素。此外,有效剂量可以从源自体外和/或体内动物模型的剂量-反应曲线外推。
因此,本公开的肽和其它活性成分(如果包括的话)的合适剂量将随患者而变化,并且还将取决于胰腺癌的阶段。在一些实施方案中,取决于所涉及的治疗的性质,所述剂量构成治疗有效量或预防有效量。肽在个体中引发期望的反应的能力也将是一个因素。示例性的每日剂量为:0.1至250mg/kg、或0.1至200或100mg/kg、或0.5至100mg/kg、或1至50或1至10mg/kg的活性成分。这可以作为单一单位剂量施用或作为每天超过一次施用的多个单位剂量施用,例如皮下、腹膜内或静脉内施用。然而,应当注意,适当的剂量可以随患者而变化,并且对于任何特定受试者,特定剂量方案应根据患者的个体需要随时间进行调整。因此,认为本文阐述的剂量范围是示例性的,并不意图限制所要求保护的组合物或方法的范围或实践。
用于治疗胰腺癌的试剂盒
一方面,本发明还提供了用于治疗胰腺癌的试剂盒,其包含肽a和/或肽b或其变体或包含肽a和/或肽b或其变体的组合物。试剂盒可以包含一个或多个其它元件,包括但不限于用法说明;其它治疗剂(即用于胰腺癌的联合疗法);其它试剂,例如用于制备用于施用的组合物的稀释剂、装置或其它材料;药学上可接受的载体;以及用于向受试者施用的装置或其它材料。用法说明可包括用于治疗应用的说明,包括建议的剂量和/或施用模式,例如在人受试者中,如本文所述。在一些实施方案中,所述试剂盒用于如本文所述的方法和用途,例如,治疗、诊断或成像方法,或用于体外测定或方法。
在一些实施方案中,所述试剂盒用于诊断胰腺癌,并且任选地包括使用试剂盒组分诊断胰腺癌的用法说明。
动物模型
如上所述,改善胰腺癌受试者预后的一个主要障碍是缺乏治疗时间窗。早期癌性病变远远低于检测阈值。到诊断时,即使早期(t1)肿瘤可以是转移性的并且对常规治疗有抗性。体外和体内实验成功与临床试验中的失望之间的差异可能源于当前实验设备在重建肿瘤微环境中的效率低下。胰腺导管腺癌的纤维化基质(其可以形成超过80%的肿瘤块)不是恶性细胞的被动支架;相反,它们在致癌过程中发挥积极的作用。这是在异种/同种移植小鼠模型中经常缺失的组分(erkan等人2012currmolmed12(3):288-303;olive等人2009science324(5933):1457-61)。
因此,动物中胰腺癌的模型对于肽a的临床前测试是至关重要的。被认为是胰腺癌中的药物开发的黄金标准的kp16转基因小鼠模型是ras驱动的条件性胰腺癌模型(胰腺癌特异性rasg12d等位基因的敲入和p16/p19基因座的敲除(aguirre等人2003genes&dev17(24):3112-26)。这些动物形成非常像人胰腺癌的自发性胰腺癌。此外,动物有完全免疫能力。虽然纯合小鼠具有平均寿命,但敲除小鼠具有约为59天的寿命。
异位hpac异种移植模型构成植入免疫受损小鼠中的人hpac癌细胞。异位hpac异种移植模型以前已经成功地用于评估胰腺癌中免疫治疗的优点(abate-daga等人2014hugenether25(12):1003-1012)。
实施例
提供以下实施例仅用于阐述目的,并不意图限制本发明的范围。
实施例1.多肽结合
经由靶向调节炎症的各种信号传导途径的特异性组分的肽结合研究,鉴定出肽a具有抗炎活性。先前使用波士顿大学开发的基于网络的clusprotm算法评估肽结合。肽a表明对relb、tgfβ、notch1、wnt8r、trail、il-6r、il-10r、egfr和cdk6的高结合亲和力。肽a还表明对组蛋白修饰酶hmt以及与巨噬细胞活性和凋亡相关的蛋白质(都与炎症和肿瘤发生和转移相关)(如cd47、sirp-α、cd206和tgm2)的高结合亲和力。最后,发现肽a对人血清白蛋白(hsa)具有高结合亲和力。血清白蛋白是循环中最丰富的蛋白质,并且实体瘤(特别是胰腺肿瘤)会将血清白蛋白吸收到其细胞中(通过胞饮过程)并将其用作能量来源。
鉴于炎症在肿瘤发生和转移中的重要作用,m2巨噬细胞活性与肿瘤发展的已知关联,以及cd47/sirp相互作用能够致使m1巨噬细胞活性丧失的指示,预计本公开的肽的施用可以积极地影响胰腺癌治疗的结果。
实施例2.肽a抑制kp16小鼠模型中的体内肿瘤生长
肽a在胰腺癌的kp16转基因小鼠模型中与吉西他滨联合改善存活(图1b)。选择具有期望的基因型(pdx-1-cre;lsl-krasg12d/+;ink4a(p16)/arf(p19)flox/flox)的小鼠,并从第6周开始经腹部超声筛选。选择2-4mm2之间的肿瘤用于处理。将具有肿瘤的小鼠随机分配到以下处理:媒介物(腹膜内注射100μlh2o或pbs);50mg/kg每周两次吉西他滨,在100μlpbs体积中通过腹膜内注射;20mg/kg肽a,在100μlh2o中通过腹腔注射每周两次给予;以及每周两次以20mg/kg的剂量给予的肽a与每周两次50mg/kg吉西他滨的组合,在其相应的溶剂中。肽a在转基因动物中停止胰腺癌的生长(图1a和1b;肽a显示为“rp-182”)。
肽b与吉西他滨组合同样证明了抗肿瘤活性,既延长存活又降低肿瘤生长。
实施例3.肽a+吉西他滨在胰腺癌中显示比其它药剂更大的功效
当各自在胰腺癌的相当的动物模型中将肽a和吉西他滨的组合(肽a+吉西他滨)与临床试验中的其它研究药剂(一种甚至已获得监管批准)进行比较时,肽a显示相对于对照更大的平均存活的百分比增加。用于比较目的的研究药物包括sb225002/tgfbrko/kras,其抑制cxcr2并且破坏肿瘤-基质相互作用,并改善胰腺导管腺癌的小鼠模型中的存活(参见hideakiijichi等人2011;thejournalofclinicalinvestigation;在此文章中,仅提供了药物和媒介物对照的数据);ipi-926/trp53r172h/kras,其抑制hedgehog信号传导并增强胰腺癌小鼠模型中化疗的递送(参见kennethp.olive等人2009;science);pegh20/trp53r172h/kras,具有基质的酶促靶向,并且消除胰腺导管腺癌治疗的物理障碍(参见paoloprovenzano等人2012;cancercell)。对于每项引用的研究,审查总体存活结果,并且将媒介物处理的分组的结果设置为对照。存活变化或肿瘤生长变化(在原始出版物中为记录的中值)作为每个分组的%变化绘图(图2;肽a显示为‘rp182’)。
用于比较测试的其它研究药剂包括在ras驱动的tgfbrko/krasg12d动物模型中测试的sb225002(ijichi等人,2011jclininvest)或在pdx/trp53r172h/krasg12dkpc模型中测试的ipi-926(olive等人2009science)或也在pdx/trp53r172h/krasg12dkpc模型中测试的pegh20(provenanzo等人,2012cell),ipi-926和pegh20既作为单一药剂又与吉西他滨联合给予。
如根据标准化的平均肿瘤体积的百分比变化所示,肽a+吉西他滨也表现出肿瘤生长的强烈(和相当的,如果不是略微改善的话)降低(图3;肽a显示为‘rp182’)。用于比较检测的其它研究药剂包括sb225002;ipi-926(来自infinitypharmaceuticals的用于胰腺腺癌的研究治疗);pegh20(推荐用于与nab-紫杉醇
在图4中以存活的%增加相对于肿瘤体积的%变化的比率(肽a显示为‘rp182’)概括了研究药剂与吉西他滨组合在胰腺癌转基因动物模型中的相对益处。与随后进入临床试验的上述研究药剂相比,肽a与吉西他滨的联合显示与最多存活延长相关的肿瘤生长的最大降低。
实施例4.肽a显示特异性细胞结合
为了阐明肽a的细胞和/或分子靶标,将后者与p16胰腺癌细胞的结合与随机的10聚体肽的结合进行了比较。将c末端生物素标记(通过8(gly)接头+cys)与pl6胰腺癌细胞以增加的浓度孵育10分钟,洗去过量的肽,并将细胞与氟标记的链霉抗生物素蛋白再孵育,并通过流式细胞术分析。对于每种浓度绘制链霉抗生物素蛋白标记的细胞与总细胞的分数,并且构建完整的ec50药物结合曲线(inglese等人,2006pnasusa103(31):11473-8)。如图5中所示,与随机10聚体生物素化肽(“elim肽”)比较c末端生物素化的肽a(“rp-182”)的结合显示肽a结合对p16胰腺癌细胞是特异的。与对照10聚体肽的无(或非特异性)结合相比,结合曲线(完全ia类曲线,s形形状)的形状和构造指示“促进结合”,即通过特异性细胞表面机制结合,其与计算机中的计算机建模数据一致。另外,肽a与对照10聚体肽相比表现出超过5倍的对癌细胞的更强结合(图5)。
实施例5.肽a经由其n-末端结合细胞
为了测定肽a是否经由其n-或c-末端结合癌细胞,n和c-末端标记的肽a(‘rp182’)的细胞结合,然后经由流式细胞术测定结合:未结合的细胞分数,如前述实施例中那样进行。图6中的ec50曲线显示经由n-末端优先结合癌细胞。通过肽a的n末端的生物素化引起的空间位阻导致对数倍数减少的细胞结合。
实施例6.肽a抑制胰腺癌的异种移植模型中的体内肿瘤生长
在另一种胰腺癌小鼠模型中测试肽a:异位hpac异种移植模型(植入免疫受损小鼠中的人hpac癌细胞)。将1x106个人胰腺细胞(萤光素酶标记)注射到32只无胸腺裸鼠中。然后,对小鼠给予(注射)媒介物、肽a、吉西他滨、或肽a+吉西他滨,对于肽a一周两次腹膜内以20mg/kg的浓度和一周一次用120mg/kg吉西他滨。在处理4周后,收获肿瘤和脾脏,并且进行cd11b+磁性细胞分离。与hpac在体外共培养分离的cd11b+细胞。经由萤光素酶标记的癌细胞的萤光素酶活性来定量癌细胞存活力。与cd11b共培养的从经媒介物处理的动物获得的细胞相比,从经肽a处理的动物获得的cd11b阳性细胞抑制癌细胞生长。
发现肽a在胰腺癌的异种移植模型中抑制体内肿瘤生长。如图7所示,用媒介物、肽a(在图7中指示为‘rp182’)、吉西他滨以及吉西他滨和肽a的组合(“吉西他滨+rp-182”)处理hpac胰腺癌细胞异种移植物,直到小鼠达到其预先确定的终点(由研究兽医指导的安乐死),并称重肿瘤。将肿瘤体积记录为相对于媒介物处理小鼠的变化。肽a在胰腺癌的异种移植小鼠模型中未表明毒性(数据未显示)。观察到媒介物与肽a之间(*p=0.007)和单独的吉西他滨与吉西他滨联合肽a(**p<0.001)之间肿瘤体积的统计学显著性差异。
实施例7.肽b影响胰腺癌中的免疫系统
致力于研究肽b是否影响胰腺癌中的免疫系统,相对于腹膜内每日2mg/kg用肽b处理,切除用媒介物处理的p16肿瘤,消化,与先前滴定和优化的免疫细胞标志物一起孵育,并且通过多色流式细胞术分析。图8中显示了各种细胞亚群的细胞分数。发现肽b(显示为‘rp-398’)通过增加这些肿瘤中的b细胞并且减少这些肿瘤中的巨噬细胞来影响胰腺癌中的免疫系统。
实施例8.来自未处理的小鼠相对于经处理的小鼠的肿瘤相关巨噬细胞差异表现
发现从经肽a处理的肿瘤相对于未处理的肿瘤分离的巨噬细胞差异表现。在>1.5cm时收获经处理的hpac异种移植物(无论用媒介物还是20mg/kg肽a,每周两次通过腹膜内注射),消化,并通过磁珠下拉(pull-down)分离cd11b细胞。通过流式细胞术确认下拉>80%后的cd11b阳性细胞的富集。将分离的cd11b阳性细胞以比率3:1和10:1与5,000个萤光素酶标记的hpac细胞共培养,并使用萤光素酶标签活性测定癌细胞的生长。来自经肽a处理的肿瘤的巨噬细胞在与它们共培养时具有增加的抗肿瘤活性并停止癌细胞的生长(数据未显示)。
实施例9:可以在鼠血清和人血清中测量肽a
使用质谱法量化小鼠血清中的肽a(数据未显示)。在本文所述的小鼠研究中使用的剂量下腹膜内注射导致可以发挥生物效应的可测量的血清浓度。肽a在延长梯度的情况下在5分钟后以质量688.08在离子质谱仪上可检测到。肽a对小鼠血清的掺入实验证实了相同的质量和飞行时间。对于要能够施加生物功能的肽a,计算的血清浓度(ng/ml)成线(数据未显示)。这种在小鼠血清中测量肽的能力是药代动力学和毒性研究的基础。
序列表
<110>乌多·鲁德洛夫
杰西·m·杰尼斯
亨利·w·洛佩兹
乔治·r·马丁
克莱顿·耶茨
<120>用于治疗胰腺癌的基于肽的方法
<130>6137nci-38-pct
<140>尚未分配
<141>2015-10-13
<150>62/063,909
<151>2014-10-14
<160>2
<170>patentinversion3.5
<210>1
<211>10
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>1
lysphearglysalaphelysargphephe
1510
<210>2
<211>10
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>2
phealalyslysphealalyslysphelys
1510
- 还没有人留言评论。精彩留言会获得点赞!