肿瘤曲妥珠单抗靶向anti‑miR‑21纳米粒子及其制备方法与流程
本发明涉及一种核酸药物靶向载体,特别涉及一种可以在肿瘤组织局部靶向性投递核酸类药物的肿瘤曲妥珠单抗靶向anti-miR-21纳米粒子及其制备方法。
背景技术:
以核酸分子作为药物的治疗方法在癌症治疗领域是研究热点之一,这种方法通过两种不同的途径发挥作用,一种是在基因组中添加新的基因材料来弥补缺失基因的功能,另外一种是阻止有害基因的表达。
靶向治疗是针对肿瘤驱动基因的精准抗肿瘤治疗,目前已成为继手术和放化疗之外的重要治疗手段,如针对驱动基因HER2的曲妥珠单抗联合化疗可明显提高HER2阳性的胃癌或者乳腺癌的治疗效果,但是疗效也存在一定局限性,使用一段时间后往往出现临床耐药现象。研究发现miR-21高表达可降低曲妥珠单抗对HER2阳性胃癌细胞的抗肿瘤作用,以miRNA-21为靶标的反义核酸(anti-miR-21oligonucleotide,AMO-21)负载基因载体降低miR-21的表达水平后,可逆转赫赛汀耐药。载体一般分为两类:病毒载体和非病毒载体。病毒载体可高效转运基因,但存在转运量有限、毒性、有潜在的病毒复制可能以及花费高等缺点,非病毒型载体虽然制备简单、无免疫原性和比较安全,但是转染效率低是其致命缺点,同样广泛使用的脂质体也具有一定的细胞毒性。
近年来随着纳米技术的发展,各学科之间的交叉渗透,纳米生物技术逐渐应用于生物治疗中,在制备非病毒载体方面良好的应用前景。另外,靶向性纳米颗粒药物传输系统可以有效地实现对肿瘤组织的定位而减少非特异性药物吸收带来的副作用,现有技术中,已有许多靶向药物载体被报道:如热靶向,即在肿瘤局部进行热疗,使药物在热疗部位靶向性释放;又如磁靶向,是在肿瘤部位外加磁场,从而磁性载体定向到肿瘤。然而,由于热靶向和磁靶向都需要外界的热疗设施或磁场,在实施时,病灶的部位必须明确,因此对于病灶不明、病灶深在或者广泛转移的病灶,就不能充分发挥作用;从手段来说,也相对较为复杂。除此之外,可以通过对纳米颗粒进行表面修饰键合上靶向基团(比如小分子、肽段或者抗体)实现对癌症组织的主动靶向,一个靶向基团能够通过与细胞表面受体的多价结合显著提高配体功能化的纳米颗粒在特定细胞中的内吞效果,
技术实现要素:
技术问题:为了克服现有技术的上述缺陷,本发明提供了一种肿瘤曲妥珠单抗靶向anti-miR-21纳米粒子及其制备方法。
技术方案:本发明提供的肿瘤曲妥珠单抗靶向anti-miR-21纳米粒子,其特征在于:所述肿瘤曲妥珠单抗靶向anti-miR-21纳米粒子为抗肿瘤曲妥珠单抗靶向载药高分子负载anti-miR-21的纳米粒子,所述抗肿瘤曲妥珠单抗靶向载药高分子的结构式如式(I)所示:
本发明还提供了上述肿瘤曲妥珠单抗靶向anti-miR-21纳米粒子的制备方法,包括以下步骤:
(1)二甲酰亚胺化聚乙二醇的制备:
(1.1)磺酰化聚乙二醇(sTO-PEG-OTs)的制备:在三乙胺存在下,以PEG2000和对甲苯磺酰氯(Tscl)为原料制得磺酰化聚乙二醇(sTO-PEG-OTs);
(1.2)二甲酰亚胺化聚乙二醇(PI-PEG-PI)的制备:磺酰化聚乙二醇(sTO-PEG-OTs)和邻苯二甲酰亚胺钾反应,制得二甲酰亚胺化聚乙二醇(PI-PEG-PI);
反应式如下:
(2)一端氨基被Boc保护的两端氨基化的聚乙二醇(Boc-PEG-NH2)的制备:
(2.1)两端氨基化聚乙二醇(NH2-PEG-NH2)的制备:二甲酰亚胺化聚乙二醇(PI-PEG-PI)和水合肼反应,制得两端氨基化聚乙二醇(NH2-PEG-NH2);
(2.2)一端被Boc保护的两端氨基化聚乙二醇的制备:在碳酸氢钠(NaHCO3)存在下,两端氨基化聚乙二醇(NH2-PEG-NH2)和二碳酸二叔丁酯(Boc2O)、1,4-二氧六环(1,4-dioxane)反应,制得一端被Boc保护的两端氨基化聚乙二醇(Boc-PEG-NH2);
反应式如下:
(3)PEG端氨基化的PEG-PCL共聚物(Boc-PEG-PCL)的制备:
(3.1)末端氨基保护的聚乙二醇-聚己内酯(Boc-PEG-PCL)的制备:在氮气保护下,以辛酸亚锡(stannous octoate)为催化剂,一端被Boc保护的两端氨基化聚乙二醇(Boc-PEG-NH2)和己内酯(ε-CL)开环聚合反应,制得末端氨基保护的聚乙二醇-聚己内酯(Boc-PEG-PCL);
(3.2)聚乙二醇-聚己内酯(NH2-PEG-PCL)的制备:末端氨基保护的聚乙二醇-聚己内酯(Boc-PEG-PCL)和三氟乙酸(Trifluoroacetic acid,TFA)反应,制得聚乙二醇-聚己内酯(NH2-PEG-PCL);
反应式如下:
(4)曲妥珠单抗-聚乙二醇-聚己内酯(HER-PEG-PCL)的制备;
在碳二亚胺(EDAC)、N-羟基硫代琥珀酰亚胺(Suflo-NHS)存在下,聚乙二醇-聚己内酯(NH2-PEG-PCL)末端的氨基和曲妥珠单抗末端的羧基发生酰胺化反应,制得曲妥珠单抗-聚乙二醇-聚己内酯(HER-PEG-PCL);
反应式如下:
(5)曲妥珠单抗靶向载药高分子纳米粒子的制备:
将曲妥珠单抗-聚乙二醇-聚己内酯(HER-PEG-PCL)冷冻干燥,即得曲妥珠单抗靶向载药高分子纳米粒子;
(6)负载anti-miR-21的曲妥珠单抗靶向高分子纳米粒子(HER-PEG-PCL-anti-miR-21)的制备:
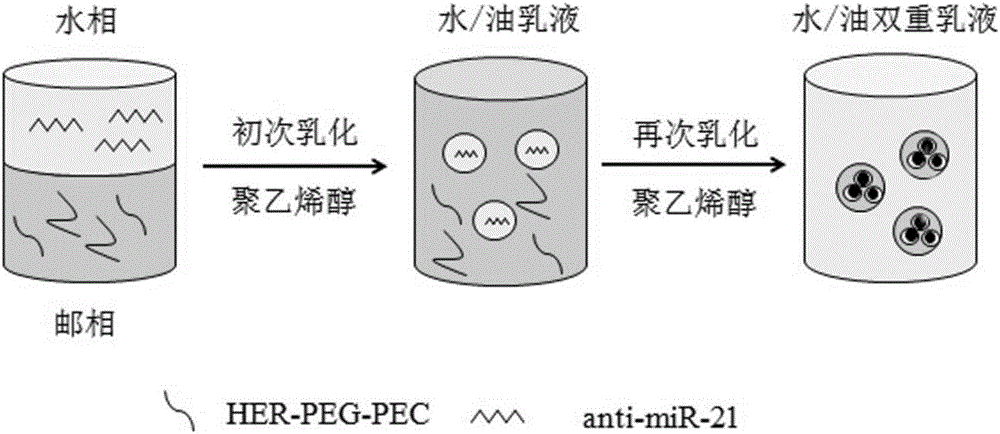
采用双乳液溶剂挥发法制备负载anti-miR-21的曲妥珠单抗靶向高分子纳米粒子(HER-PEG-PCL-anti-miR-21):将曲妥珠单抗-聚乙二醇-聚己内酯(HER-PEG-PCL)溶于有机溶剂中,再加入anti-miR-21混匀,再滴入浓聚乙烯醇水溶液,超声反应;产物倒入稀聚乙烯醇水溶液中,超声分散;室温搅拌使有机溶剂挥发,离心、洗涤、冷冻干燥,即得负载anti-miR-21的曲妥珠单抗靶向高分子纳米粒子。
步骤(1.1)中,反应温度为室温,反应时间为18-30h;PEG2000和对甲苯磺酰氯(Tscl)的用量比为1:(2-3),三乙胺在反应溶剂中的质量百分比浓度为0.3-1.0%。
步骤(1.2)中,反应温度为110-130℃,反应时间为8-16h;磺酰化聚乙二醇(sTO-PEG-OTs)和邻苯二甲酰亚胺钾的用量比为1:(2-3)。
步骤(2.1)中,反应温度为70-90℃,反应时间为8-16h;二甲酰亚胺化聚乙二醇(PI-PEG-PI)和水合肼的用量比为1:(2-3)。
步骤(2.2)中,反应温度为-5℃-5℃,反应时间为18-30h;两端氨基化聚乙二醇(NH2-PEG-NH2)和二碳酸二叔丁酯(Boc2O)的用量比为1:(1-2);1,4-二氧六环(1,4-dioxane)在反应溶剂中的质量百分比浓度为1.5-2.0%;碳酸氢钠(NaHCO3)在反应溶剂中的质量百分比浓度为1.5-2.0%,反应体系pH为7.0-7.5。
步骤(3.1)中,反应温度为120-140℃,反应时间为4-8h;一端被Boc保护的两端氨基化聚乙二醇(Boc-PEG-NH2)和己内酯(ε-CL)的用量比为1:(1.0-1.5)。
步骤(3.2)中,反应温度为室温,反应时间为0.5-2h;末端氨基保护的聚乙二醇-聚己内酯(Boc-PEG-PCL)和三氟乙酸(Trifluoroacetic acid,TFA)的用量比为1:(4-6)。
步骤(4)中,反应体系pH8.0-9.0,反应温度为室温,反应时间为8-12h;聚乙二醇-聚己内酯(NH2-PEG-PCL)和曲妥珠单抗的用量比为1:(1-2)。
步骤(5)中,冷冻干燥工艺具体为:将曲妥珠单抗-聚乙二醇-聚己内酯(HER-PEG-PCL)溶于体积比(1-3):2的乙醇和丙酮混合溶液中,得到的溶液滴入20-30倍等体积的冷存水中,减压抽除有机溶剂,即得。
步骤(6)中,所述有机溶剂为二氯甲烷;所述曲妥珠单抗-聚乙二醇-聚己内酯(HER-PEG-PCL)、anti-miR-21、有机溶剂、浓聚乙烯醇水溶液、稀聚乙烯醇水溶液的用量比为(2-5)mg:(12-30)μg:0.1mL:(0.5-0.7)mL:(0.2-0.3)mL;所述浓聚乙烯醇水溶液的质量百分比浓度为3-8%;超声反应功率为10-30W,超声反应时间为20-40s;所述稀聚乙烯醇水溶液的质量百分比浓度为0.1-0.5%;超声分散功率为10-30W,超声分散时间为20-40s。
有益效果:本发明提供的肿瘤曲妥珠单抗靶向anti-miR-21纳米粒子靶向性好、毒副作用小,其制备方法通过通过开环聚合法和复乳-溶剂挥发法获得负载核酸药物的高分子纳米粒子,工艺简单、收率高、副反应少。
本发明利用HER-PEG-PCL对部分特异性表达HER2的胃癌亚型给药,本发明载体可靶向将药物投递至肿瘤部位并释放,使药物被肿瘤组织靶向摄取;同时,通过SDS-PAGE检测,曲妥珠单抗连接到PEG-PCL上后,其生物学活性没有发生明显的改变。进一步通过体外实验证实,相对于曲妥珠单抗裸药,用含有同等曲妥珠单抗药物浓度的HER-PEG-PCL对HER2阳性的胃癌细胞抑制率相当;然而,该靶向纳米粒子能有效靶向投递到肿瘤组织,可有效降低对不表达人表皮生长因子受体2(human epidermal growth factor receptor-2,HER2)的正常组织的毒副作用,同时又能通过曲妥珠单抗的ADCC(antibody-dependent cell-mediated cytotoxicity,抗体依赖的细胞介导的细胞毒性作用)抑制肿瘤细胞的生长,有效解决了抗肿瘤靶向药物载体,药物投递系统各自存在的缺陷,并且作为转染载体负载反义核酸药物敲弱miR-21表达后可增强曲妥珠单抗的抗肿瘤疗效。
现有技术中,曲妥珠单抗的药代动力学说明了它是剂量依赖性药物,提高药物剂量可能会增加抗肿瘤疗效,但随着药物剂量的增加,其心脏毒毒副作用也随之增高,对于初次治疗使用过蒽环类药物的患者也会增加心衰的发生率。然而,本发明采用曲妥珠单抗与载体共轭连接给药后,可以通过EPR效应靶向投递到肿瘤组织,避免曲妥珠单抗对正常心肌细胞的毒性,增加了患者的耐受性后,可尝试提高曲妥珠单抗局部给药剂量。
附图说明
图1A为曲妥珠单抗靶向纳米载体(HER-PEG-PCL)的制备原理图;
图1B为载anti-miR-21曲妥珠单抗靶向高分子纳米粒子(HER-PEG-PCL-anti-miR-21)的制备原理图;
图2为XPS检测曲妥珠单抗连接前后纳米粒子氮原子含量示意图;
图3为曲妥珠单抗和曲妥珠单抗连接PEG-PCL后SDS-PAGE电泳结果示意图;
图4为不同实验组对HER2阳性胃癌细胞NUGC4(A)和正常胃黏膜上皮细胞GSE-1细胞(B)毒性示意图。
图5为NUGC4和SGC7901胃癌细胞株对肿瘤曲妥珠单抗靶向anti-miR-21纳米粒子(HER-PEG-PCL-anti-miR-21)和空白NPs的转染效率比较示意图;
图6为lipofectamine2000-anti-miR-21、PEG-PCL-anti-miR-21、HER-PEG-PCL-anti-miR-21在NUGC4细胞作用前后miR-21表达水平变化情况图;
图7为通过琼脂糖凝胶电泳方法检测anti-miR-21、PEG-PCL-anti-miR-21、HER-PEG-PCL-anti-miR-21在小牛血清中的稳定性。
具体实施方式
下面对本发明作出进一步说明。
说明书中,各缩写的含义为:
anti-miR-21(miR-21的反义核苷酸)
PEG-PCL-anti-miR-21(负载anti-miR-21的PEG-PCL纳米粒子)
HER-PEG-PCL-anti-miR-21(曲妥珠单抗-NPs-anti-miR-21,负载anti-miR-21曲妥珠单抗靶向PEG-PCL纳米粒子)
lipofectamine2000-anti-miR-21(lipofectamine2000为载体转染anti-miR-21)
曲妥珠单抗-NPs-anti-miR-21(负载anti-miR-21曲妥珠单抗靶向PEG-PCL纳米粒子)
NPs-anti-miR-21(负载anti-miR-21的PEG-PCL纳米粒子)
HER-PEG-PCL(曲妥珠单抗靶向PEG-PCL纳米粒子)
本发明中,m、n均为正数。
实施例1
肿瘤曲妥珠单抗靶向anti-miR-21纳米粒子(HER-PEG-PCL-anti-miR-21)的制备方法,包括以下步骤:
(1)二甲酰亚胺化聚乙二醇的制备:
(1.1)磺酰化聚乙二醇(sTO-PEG-OTs)的制备:二氯甲烷溶剂中,在三乙胺存在下,以摩尔比1:2.5的PEG2000和对甲苯磺酰氯(Tscl)为原料,室温反应24h制得磺酰化聚乙二醇(sTO-PEG-OTs);三乙胺在溶剂中的质量百分比浓度为0.5%;
(1.2)二甲酰亚胺化聚乙二醇(PI-PEG-PI)的制备:摩尔比1:2.5的磺酰化聚乙二醇(sTO-PEG-OTs)和邻苯二甲酰亚胺钾120℃反应12h,制得二甲酰亚胺化聚乙二醇(PI-PEG-PI);
(2)一端氨基被Boc保护的两端氨基化的聚乙二醇(Boc-PEG-NH2)的制备:
(2.1)两端氨基化聚乙二醇(NH2-PEG-NH2)的制备:摩尔比1:2.5的二甲酰亚胺化聚乙二醇(PI-PEG-PI)和水合肼80℃反应12h,制得两端氨基化聚乙二醇(NH2-PEG-NH2);
(2.2)一端被Boc保护的两端氨基化聚乙二醇的制备:在碳酸氢钠(NaHCO3)存在下,摩尔比1:2.5的两端氨基化聚乙二醇(NH2-PEG-NH2)和二碳酸二叔丁酯(Boc2O)、1,4-二氧六环(1,4-dioxane)0℃反应24h,制得一端被Boc保护的两端氨基化聚乙二醇(Boc-PEG-NH2);1,4-二氧六环(1,4-dioxane)在反应溶剂中的质量百分比浓度为1.8%;碳酸氢钠(NaHCO3)在反应溶剂中的质量百分比浓度为1.8%,反应体系pH为7.2;
(3)PEG端氨基化的PEG-PCL共聚物(Boc-PEG-PCL)的制备:
(3.1)末端氨基保护的聚乙二醇-聚己内酯(Boc-PEG-PCL)的制备:在氮气保护下,以辛酸亚锡(stannous octoate)为催化剂,摩尔比1:1.2的一端被Boc保护的两端氨基化聚乙二醇(Boc-PEG-NH2)和己内酯(ε-CL)130℃开环聚合反应6h,制得末端氨基保护的聚乙二醇-聚己内酯(Boc-PEG-PCL);
(3.2)聚乙二醇-聚己内酯(NH2-PEG-PCL)的制备:摩尔比1:5的末端氨基保护的聚乙二醇-聚己内酯(Boc-PEG-PCL)和三氟乙酸(Trifluoroacetic acid,TFA)室温反应1h,制得聚乙二醇-聚己内酯(NH2-PEG-PCL);
(4)曲妥珠单抗-聚乙二醇-聚己内酯(HER-PEG-PCL)的制备;
pH8.5硼酸缓冲液中,在碳二亚胺(EDAC)、N-羟基硫代琥珀酰亚胺(Suflo-NHS)存在下,摩尔比1:1.5的聚乙二醇-聚己内酯(NH2-PEG-PCL)末端的氨基和曲妥珠单抗末端的羧基室温酰胺化反应10h,制得曲妥珠单抗-聚乙二醇-聚己内酯(HER-PEG-PCL);
(5)曲妥珠单抗靶向高分子纳米粒子的制备:
将曲妥珠单抗-聚乙二醇-聚己内酯(HER-PEG-PCL)溶于体积比1:1的乙醇和丙酮混合溶液中,得到的溶液滴入25倍等体积的冷存水中,减压抽除有机溶剂,即得。
(6)负载anti-miR-21曲妥珠单抗靶向高分子纳米粒子(HER-PEG-PCL-anti-miR-21)的制备:
采用双乳液溶剂挥发法制备负载anti-miR-21的曲妥珠单抗靶向高分子纳米粒子(HER-PEG-PCL-anti-miR-21):将3mg曲妥珠单抗-聚乙二醇-聚己内酯(HER-PEG-PCL)溶于0.1mL二氯甲烷中,再加入500μg anti-miR-21(anti-miR-21与亚精胺混合物,N:P比为1:10,含anti-miR-21 20μg,混匀;再滴入0.6mL 5%浓聚乙烯醇水溶液,20W超声反应30s,产物倾倒至2.4mL含有0.3%稀聚乙烯醇水溶液中,20W超声分散30s,室温搅拌3h使二氯甲烷挥发,离心、洗涤、冷冻干燥48h,即得。
实施例2
肿瘤曲妥珠单抗靶向anti-miR-21纳米粒子(HER-PEG-PCL-anti-miR-21)的制备方法,包括以下步骤:
(1)二甲酰亚胺化聚乙二醇的制备:
(1.1)磺酰化聚乙二醇(sTO-PEG-OTs)的制备:二氯甲烷溶剂中,在三乙胺存在下,以摩尔比1:2的PEG2000和对甲苯磺酰氯(Tscl)为原料,室温反应30h制得磺酰化聚乙二醇(sTO-PEG-OTs);三乙胺在溶剂中的质量百分比浓度为1.0%;
(1.2)二甲酰亚胺化聚乙二醇(PI-PEG-PI)的制备:摩尔比1:2的磺酰化聚乙二醇(sTO-PEG-OTs)和邻苯二甲酰亚胺钾110℃反应16h,制得二甲酰亚胺化聚乙二醇(PI-PEG-PI);
(2)一端氨基被Boc保护的两端氨基化的聚乙二醇(Boc-PEG-NH2)的制备:
(2.1)两端氨基化聚乙二醇(NH2-PEG-NH2)的制备:摩尔比1:2的二甲酰亚胺化聚乙二醇(PI-PEG-PI)和水合肼70℃反应16h,制得两端氨基化聚乙二醇(NH2-PEG-NH2);
(2.2)一端被Boc保护的两端氨基化聚乙二醇的制备:在碳酸氢钠(NaHCO3)存在下,摩尔比1:1的两端氨基化聚乙二醇(NH2-PEG-NH2)和二碳酸二叔丁酯(Boc2O)、1,4-二氧六环(1,4-dioxane)-5℃反应30h,制得一端被Boc保护的两端氨基化聚乙二醇(Boc-PEG-NH2);1,4-二氧六环(1,4-dioxane)在反应溶剂中的质量百分比浓度为1.5%;碳酸氢钠(NaHCO3)在反应溶剂中的质量百分比浓度为1.5%,反应体系pH为7.0;
(3)PEG端氨基化的PEG-PCL共聚物(Boc-PEG-PCL)的制备:
(3.1)末端氨基保护的聚乙二醇-聚己内酯(Boc-PEG-PCL)的制备:在氮气保护下,以辛酸亚锡(stannous octoate)为催化剂,摩尔比1:1.0的一端被Boc保护的两端氨基化聚乙二醇(Boc-PEG-NH2)和己内酯(ε-CL)120℃开环聚合反应8h,制得末端氨基保护的聚乙二醇-聚己内酯(Boc-PEG-PCL);
(3.2)聚乙二醇-聚己内酯(NH2-PEG-PCL)的制备:摩尔比1:4的末端氨基保护的聚乙二醇-聚己内酯(Boc-PEG-PCL)和三氟乙酸(Trifluoroacetic acid,TFA)室温反应0.5h,制得聚乙二醇-聚己内酯(NH2-PEG-PCL);
(4)曲妥珠单抗-聚乙二醇-聚己内酯(HER-PEG-PCL)的制备;
pH8.0硼酸缓冲液中,在碳二亚胺(EDAC)、N-羟基硫代琥珀酰亚胺(Suflo-NHS)存在下,摩尔比1:1的聚乙二醇-聚己内酯(NH2-PEG-PCL)末端的氨基和曲妥珠单抗末端的羧基室温酰胺化反应8h,制得曲妥珠单抗-聚乙二醇-聚己内酯(HER-PEG-PCL);
(5)曲妥珠单抗靶向载药高分子纳米粒子的制备:
将曲妥珠单抗-聚乙二醇-聚己内酯(HER-PEG-PCL)溶于体积比1:2的乙醇和丙酮混合溶液中,得到的溶液滴入20倍等体积的冷存水中,减压抽除有机溶剂,即得。
(6)负载anti-miR-21曲妥珠单抗靶向高分子纳米粒子(HER-PEG-PCL-anti-miR-21)的制备:
采用双乳液溶剂挥发法制备负载anti-miR-21的曲妥珠单抗靶向高分子纳米粒子(HER-PEG-PCL-anti-miR-21):将2mg曲妥珠单抗-聚乙二醇-聚己内酯(HER-PEG-PCL)溶于0.1mL二氯甲烷中,再加入400μg anti-miR-21(anti-miR-21与亚精胺混合物,N:P比为1:10,含anti-miR-21 30μg,混匀;再滴入0.5mL 8%浓聚乙烯醇水溶液,30W超声反应20s,产物倾倒至2.0mL含有0.1%稀聚乙烯醇水溶液中,30W超声反应20s,室温搅拌3h使二氯甲烷挥发,离心、洗涤、冷冻干燥48h,即得。
实施例3
肿瘤曲妥珠单抗靶向anti-miR-21纳米粒子(HER-PEG-PCL-anti-miR-21)的制备方法,包括以下步骤:
(1)二甲酰亚胺化聚乙二醇的制备:
(1.1)磺酰化聚乙二醇(sTO-PEG-OTs)的制备:二氯甲烷溶剂中,在三乙胺存在下,以摩尔比1:3的PEG2000和对甲苯磺酰氯(Tscl)为原料,室温反应18h制得磺酰化聚乙二醇(sTO-PEG-OTs);三乙胺在溶剂中的质量百分比浓度为0.3%;
(1.2)二甲酰亚胺化聚乙二醇(PI-PEG-PI)的制备:摩尔比1:3的磺酰化聚乙二醇(sTO-PEG-OTs)和邻苯二甲酰亚胺钾130℃反应8h,制得二甲酰亚胺化聚乙二醇(PI-PEG-PI);
(2)一端氨基被Boc保护的两端氨基化的聚乙二醇(Boc-PEG-NH2)的制备:
(2.1)两端氨基化聚乙二醇(NH2-PEG-NH2)的制备:摩尔比1:(2-3)的二甲酰亚胺化聚乙二醇(PI-PEG-PI)和水合肼90℃反应8h,制得两端氨基化聚乙二醇(NH2-PEG-NH2);
(2.2)一端被Boc保护的两端氨基化聚乙二醇的制备:在碳酸氢钠(NaHCO3)存在下,摩尔比1:2的两端氨基化聚乙二醇(NH2-PEG-NH2)和二碳酸二叔丁酯(Boc2O)、1,4-二氧六环(1,4-dioxane)5℃反应18h,制得一端被Boc保护的两端氨基化聚乙二醇(Boc-PEG-NH2);1,4-二氧六环(1,4-dioxane)在反应溶剂中的质量百分比浓度为2.0%;碳酸氢钠(NaHCO3)在反应溶剂中的质量百分比浓度为2.0%,反应体系pH为7.5;
(3)PEG端氨基化的PEG-PCL共聚物(Boc-PEG-PCL)的制备:
(3.1)末端氨基保护的聚乙二醇-聚己内酯(Boc-PEG-PCL)的制备:在氮气保护下,以辛酸亚锡(stannous octoate)为催化剂,摩尔比1:1.5的一端被Boc保护的两端氨基化聚乙二醇(Boc-PEG-NH2)和己内酯(ε-CL)140℃开环聚合反应4h,制得末端氨基保护的聚乙二醇-聚己内酯(Boc-PEG-PCL);
(3.2)聚乙二醇-聚己内酯(NH2-PEG-PCL)的制备:摩尔比1:6的末端氨基保护的聚乙二醇-聚己内酯(Boc-PEG-PCL)和三氟乙酸(Trifluoroacetic acid,TFA)室温反应2h,制得聚乙二醇-聚己内酯(NH2-PEG-PCL);
(4)曲妥珠单抗-聚乙二醇-聚己内酯(HER-PEG-PCL)的制备;
pH9.0硼酸缓冲液中,在碳二亚胺(EDAC)、N-羟基硫代琥珀酰亚胺(Suflo-NHS)存在下,摩尔比1:2的聚乙二醇-聚己内酯(NH2-PEG-PCL)末端的氨基和曲妥珠单抗末端的羧基室温酰胺化反应12h,制得曲妥珠单抗-聚乙二醇-聚己内酯(HER-PEG-PCL);
(5)曲妥珠单抗靶向载药高分子纳米粒子的制备:
将曲妥珠单抗-聚乙二醇-聚己内酯(HER-PEG-PCL)溶于体积比3:2的乙醇和丙酮混合溶液中,得到的溶液滴入30倍等体积的冷存水中,减压抽除有机溶剂,即得。
(6)负载anti-miR-21曲妥珠单抗靶向高分子纳米粒子(HER-PEG-PCL-anti-miR-21)的制备:
采用双乳液溶剂挥发法制备负载anti-miR-21的曲妥珠单抗靶向高分子纳米粒子(HER-PEG-PCL-anti-miR-21):将5mg曲妥珠单抗-聚乙二醇-聚己内酯(HER-PEG-PCL)溶于0.1mL二氯甲烷中,再加入600μg anti-miR-21(anti-miR-21与亚精胺混合物,N:P比为1:10,含anti-miR-21 12μg,混匀;再滴入0.7mL 3%浓聚乙烯醇水溶液,10W超声反应40s,产物倾倒至3.0mL含有0.5%稀聚乙烯醇水溶液中,10W超声反应40s,室温搅拌3h使二氯甲烷挥发,离心、洗涤、冷冻干燥48h,即得。
实施例4
肿瘤曲妥珠单抗靶向anti-miR-21纳米粒子(HER-PEG-PCL-anti-miR-21)的制备,包括以下步骤:
(1)制备二甲酰亚胺化聚乙二醇:将PEG2000和对甲苯磺酰氯(Tscl)同溶解在二氯甲烷中的三乙胺常温真空干燥24小时,通过90%乙醚沉淀得合成物对甲苯磺酰化聚乙二醇(sTO-PEG-OTs),溶在二甲基甲酰胺(DMF)的溶液中的苯二甲酰亚胺钾(phthalimide potassium),120℃条件下反应12小时后得产物二甲酰亚胺化聚乙二醇(PI-PEG-PI);
(2)制备一端氨基被保护的两端氨基化聚乙二醇:PI-PEG-PI和水合肼(hydrazine hydrate)80℃无水乙醇回流反应12小时得两端氨基化聚乙二醇(NH2-PEG-NH2),将其溶解在碳酸氢钠(NaHCO3)溶液中25℃搅拌2小时,将等量的溶在1,4-二氧六环(1,4-dioxane)中的,二碳酸二叔丁酯(Boc2O)滴入溶有NH2-PEG-NH2的冰浴中,反应得Boc-PEG-NH2,使NH2-PEG-NH2一端的氨基呈保护状态,另外一端氨基和PCL通过酰胺化反应发生化学连接生成Boc-PEG-PCL;
(3)PEG端氨基化的PEG-PCL共聚物的合成:Boc-PEG-NH2在氮气保护下以辛酸亚锡(stannous octoate)为催化剂,经过130℃,6小时对己内酯(ε-CL)进行开环聚合反应得末端氨基保护的PEG-PCL共聚物(Boc-PEG-PCL),将其溶解于二氯甲烷,通过冷石油醚再沉淀。常温真空干燥至恒重。将Boc-PEG-PCL溶解在DCM和三氟乙酸(Trifluoroacetic acid,TFA)常温下反应1小时得NH2-PEG-PCL,真空干燥;
(4)将NH2-PEG-PCL和曲妥珠单抗通过酰胺化反应连接:将赫赛汀溶解在pH值为8.4的硼酸溶液中,将NH2-PEG-PCL重悬于其中,在交联剂碳二亚胺(EDAC)和硫代琥珀酰亚胺(Sulfo-NHS)的作用下,常温过夜搅拌,发生酰胺化反应生成HER-PEG-PCL,离心收集,并收取上清液检测未被连接的曲妥珠单抗的量;
(5)将HER-PEG-PCL聚合物溶于等体积的乙醇和丙酮中,再将所制得的溶液滴入25倍等体积的冷存水中,减压抽除以有机溶剂,将溶液冷冻干燥得到载体,-20℃保存。(6)负载anti-miR-21曲妥珠单抗靶向高分子纳米粒子的制备:
采用双乳液溶剂挥发法制备负载anti-miR-21的曲妥珠单抗靶向高分子纳米粒子(HER-PEG-PCL-anti-miR-21):采用双乳液溶剂挥发法制备负载anti-miR-21的曲妥珠单抗靶向高分子纳米粒子(HER-PEG-PCL-anti-miR-21):将3mg曲妥珠单抗-聚乙二醇-聚己内酯(HER-PEG-PCL)溶于0.1mL二氯甲烷中,再加入500μg anti-miR-21(anti-miR-21与亚精胺混合物,N:P比为1:10,含anti-miR-21 20μg,混匀;再滴入0.6mL 5%浓聚乙烯醇水溶液,20W超声反应30s,产物倾倒至2.4mL含有0.3%稀聚乙烯醇水溶液中,30W超声分散20s,室温搅拌3h使二氯甲烷挥发,离心、洗涤、冷冻干燥48h,即得。
比较负载化疗物后得细胞毒作用,结果见图4。
结果显示:
(1)对于HER2阳性的胃癌细胞株NUGC4,曲妥珠单抗和曲妥珠单抗-PEG-PCL的细胞抑制作用相似,因此,曲妥珠单抗-PEG-PCL纳米粒子保持了曲妥珠单抗对肿瘤细胞的ADCC细胞毒作用;负载anti-miR-21的曲妥珠单抗靶向高分子靶向纳米粒子(HER-PEG-PCL-anti-miR-21)毒性明显高于曲妥珠单抗、曲妥珠单抗+NPs-anti-miR-21组;同时作为转染载体具有靶向投递反义核酸药物的能力,从而增强了对肿瘤细胞的抑制作用;
(2)对于胃黏膜上皮细胞,曲妥珠单抗、曲妥珠单抗-NPs、曲妥珠单抗+NPs-anti-miR-21、负载anti-miR-21的曲妥珠单抗靶向高分子靶向纳米粒子(曲妥珠单抗-NPs-anti-miR-21)几乎无细胞毒性。
细胞摄取实验,通过复乳-溶剂挥发法将HER-PEG-PCL和PEG-PCL负载3′-FITC荧光素标记荧光物质标记的核酸药物FAM-anti-miR-21进行细胞转染比较实验,结果见图5。
结果显示:NUGC4的对曲妥珠单抗-PEG-PCL-anti-miR-21的转染率显高于PEG-PCL-anti-miR-21的摄取,而在SGC7901中的转染率相当,且都明显低于曲妥珠单抗-PEG-PCL-anti-miR-21在NUGC4中的转染效率。这一结果也解释了曲妥珠单抗靶向纳米粒子负载核酸药物anti-miR-21后对HER2阳性胃癌细胞的抑制作用最强。
lipofectamine2000-anti-miR-21、PEG-PCL-anti-miR-21、曲妥珠单抗-PEG-PCL-anti-miR-21在NUGC4细胞作用前后miR-21表达水平变化情况,见图6,结果显示:曲妥珠单抗-PEG-PCL作为转染载体转染的反义核酸anti-miR-21敲弱miR-21的表达水平明显优于lipofectamine2000、PEG-PCL纳米粒子。
anti-miR-21、PEG-PCL-anti-miR-21、曲妥珠单抗-PEG-PCL-anti-miR-21在小牛血清中的稳定性,见图7,结果显示:以曲妥珠单抗-PEG-PCL或者PEG-PCL作为转染载体都明显提高反义核酸药物anti-miR-21在小牛血清中的稳定性。
PEG链段上的每个乙二醇单元,都可以紧密结合两个或三个相关联的水分子,形成一层水化层,有效保护了载药颗粒之间的碰撞,增加了颗粒的稳定性;同时该水化层也像保护一样减少了颗粒与血浆蛋白的粘附,避免颗粒被快速清除,有效延长颗粒的血液循环时间,改善颗粒的药代动力学。因此,用亲水性材料PEG修饰的纳米粒在静脉注射后兼具“长循环”、“隐形”和“立体稳定”的特点,这些特点均有利于药物的靶向。但是,PEG修饰在一定程度上妨碍纳米载药颗粒与靶细胞膜的相互作用,而且降低了颗粒的内含体逃逸能力,所以设计合理的PEG化修饰的纳米体系,成为非常需要的科学问题。
本发明构建了曲妥珠单抗靶向PEG-PCL纳米载药系统,制得的肿瘤曲妥珠单抗靶向载药高分子采用曲妥珠单抗、聚乙二醇、聚己内酯的组合(其中PEG、PCL最终在体内降解为二氧化碳和水,具有良好的生物相容性,被美国FDA批准可以作为人体临床使用)其在PEG的保护下完成血液循环,通过曲妥珠单抗和胃癌表面HER2受体相互作用,增加颗粒内吞(见图1A)。
本实验应用双乳化溶剂蒸发法,将曲妥珠单抗-PEG-PCL-NPs作为基因治疗载体制备成的纳米粒经物理包埋将反义核酸anti-miR-21浓缩包裹在纳米粒,其核心为亲水性,可以溶解寡核苷酸,能保护反义寡核苷酸不被核酸酶降解。这种纳米小囊是在水油乳化中通过PVA的界面聚合作用而制备,取得了预期的miR-21抑制,提高了曲妥珠单抗的抗肿瘤效果(见图1B)。
曲妥珠单抗含有1726个氮原子,通过X射线光电子能谱学检测到连接上曲妥珠单抗的PEG-PCL其氮原子含量肯定要明显高于单纯的PEG-PCL纳米粒子,见图2:在396(ev)位置,连接曲妥珠单抗后纳米粒子(HER-PEG-PCL)氮原子含量明显要高于未连接状态下的纳米粒子(PEG-PCL)。因为曲妥珠单抗本身对HER2阳性的胃癌细胞具有ADCC作用(antibody-dependent cell-mediated cytotoxicity,抗体依赖的细胞介导的细胞毒性作用)抑制肿瘤细胞的生长,我们通过SDS-PAGE检测其通过酰胺化反应和PEG-PCL连接后是否发生变性,电泳结果表明在连接前后曲妥珠单抗并没有发生蛋白变性,见图3。
本发明载药系统通过载体自身的性质和化学修饰形成被动靶向和主动靶向效应可以一定程度上实现药物的靶向作用,在增加肿瘤局部药物浓度的同时,降低了药物全身其他部位的浓度。
- 还没有人留言评论。精彩留言会获得点赞!