一种药物靶向输送载体、制备方法及其应用与流程
本发明属于药物载体、制备方法及其应用,特别属于化疗药物及小分子干扰rna共输送载体、制备方法及应用。
背景技术:
化疗一直是癌症治疗的主要手段,但是化疗药物的体内非靶向分散使得药物在作用于肿瘤组织的同时,损伤了机体内的其他正常组织器官,从而产生多种化疗副作用,加上肿瘤细胞的多药耐药性特征,使得化疗的临床疗效不尽如人意。肿瘤细胞的多药耐药性主要体现在其细胞膜上有能量依赖型药物外排泵,可将进入细胞膜的小分子药物泵出膜外,以及肿瘤细胞的抗凋亡机制,抑制了肿瘤细胞的正常凋亡。小干扰rna技术可以有效抑制肿瘤细胞的多药耐药性,通过抑制和干扰与多药耐药性相关的基因表达,实现肿瘤细胞的药物外排和抗凋亡抑制。但是小干扰rna技术的应用同样存在体内非靶向分布、难导入细胞和血液中运输易被降解的问题。
技术实现要素:
本发明要解决的第1个技术问题是提供一种具有肿瘤组织主动靶向及血液运输中不易降解的化疗药物和生物药物靶向共输送载体。
本发明所要解决的第2个问题是上述载体的制备方法。
本发明所要解决的第3个问题是上述载体的应用。
本发明解决技术问题的技术方案为:一种药物靶向输送载体,其结构式如下:
所述的r'为-h或
所述的载体结构式的分子量为n=160-1600,r'中季铵盐、叶酸根、生物素根的取代度均不为0。
优选的季铵盐的取代度为0.59,叶酸根的取代度为0.64,生物素根的取代度为0.72。
所述的取代度为马铃薯淀粉中每个葡萄糖单元所修饰的取代基的残基数。
所述的载体的粒径分布区间为89-183nm,平均粒径约100-110nm。
本发明的制备方法包括以下步骤:
a)季铵化淀粉的制备步骤:
将马铃薯淀粉充分浸润于异丙醇中,形成淀粉异丙醇溶液,马铃薯淀粉与异丙醇的重量(g)/体积比(ml)为5:(3-5);
将质量浓度为50-60%醚化剂3-氯-2-羟丙基三甲基氯化铵(cta)与质量浓度为40-42%的naoh溶液室温混合,高速搅拌15-30分钟,生成2,3-环氧丙基三甲基氯化铵(gta)溶液,3-氯-2-羟丙基三甲基氯化铵与naoh的摩尔比为1:1-1.5;
将生成的2,3-环氧丙基三甲基氯化铵(gta)倒入淀粉异丙醇溶液中,在室温的条件下,高速搅拌1-2小时,得到混合物,将混合物密封置于60-70℃反应4-6小时,冷却至室温即生成白色季铵化淀粉初产物,加入无水乙酸中和至ph6-8,再通过真空抽滤将季铵化淀粉初产物用无水乙醇洗涤,直至滤液中滴入硝酸银没有氯化银沉淀即可;抽滤产物置于35℃烘箱干燥至恒重,即得到季铵化淀粉;淀粉葡萄糖单元与2,3-环氧丙基三甲基氯化铵的摩尔比为1:1-1.2;
b)纳米粒的制备步骤:包括b1酯化步骤、b2透析步骤、b3洗涤及干燥步骤,b4分散步骤;
所述的b1酯化步骤为将a步骤制备的季铵化淀粉、生物素、叶酸、n,n′-二环己基碳二亚胺(dcc)、n-羟基琥珀酰亚胺(nhs)和4-二甲氨基吡啶(dmap)混合溶于二甲亚砜,室温下搅拌24-48小时后,酯化生成叶酸-生物素-季铵化淀粉复合物(fbqs);所述季铵化淀粉、生物素、叶酸、n,n′-二环己基碳二亚胺、n-羟基琥珀酰亚胺和4-二甲氨基吡啶的质量比为(2.5—4):(1.5—2):(2.5—4):(2.5—4):(2.5—4):1.5;
所述的b2透析步骤为将b1酯化步骤所制的叶酸-生物素-季铵化淀粉复合物装入分子截流量为8000-14000da的透析袋,浸入去离子水中透析3天,第一天每4小时换一次新鲜的去离子水,后面是一天换一次去离子水,透析产物取出进行真空抽滤;
所述的b3洗涤及干燥步骤为将b2透析步骤抽滤好的叶酸-生物素-季铵化淀粉复合物继续通过真空抽滤的方法用无水乙醚和去离子水交替洗涤3次,再于35℃干燥至恒重;
所述的b4分散步骤为将b3洗涤及干燥步骤制备好的叶酸-生物素-季铵化淀粉复合物分散于去离子水中,用探针型超声波仪超声处理3-5分钟,经0.22微米微孔滤膜过滤除去灰尘和其它杂质,得到叶酸-生物素-季铵化淀粉纳米粒悬浮滤液,通过真空冷冻(真空度为1pa,温度为-50℃)干燥得到纳米颗粒冻干粉;叶酸-生物素-季铵化淀粉复合物与去离子水的重量(g)/体积(ml)比为1:800-1000。
所述的室温为20-25摄氏度。
所述的载体作为化疗药物和生物药物共载体的应用。
所述的化疗药物为疏水性、分子量小于1000的药物,比如阿霉素和紫杉醇。
所述的生物药物为分子量为13–15μg/nmol的干扰rna,如survivin基因的小干扰rna(sirnasur)或者bcl-2基因的小干扰rna(sibcl-2)。
本发明所制的药物载体是一种自聚的阳离子核壳型纳米微粒,是通过n,n′-二环己基碳二亚胺、n-羟基琥珀酰亚胺和4-二甲氨基吡啶催化的“一步法”方法酯化反应合成。当生物素与其它生物分子通过酯键或者酰胺键共价连接时,它的水溶性因失去了亲水的羧基而急剧降低,生物素因此可以作为疏水基团形成自聚的纳米粒子。
药物载体的疏水内核可以包载小分子疏水性化疗药物,其正电荷的亲水外壳可以静电吸附负电荷的小分子sirna。另外,叶酸与叶酸受体之间的特异性结合使叶酸可以作为靶向配基与纳米微粒共价结合,纳米粒子对叶酸受体过表达的肿瘤细胞均具有特异性主动靶向作用。;疏水性抗癌药物阿霉素和sirna分别通过疏水作用和静电吸附作用被包载进叶酸-生物素-季铵化淀粉纳米微粒中,且表现出良好的血清稳定性。化疗药物和sirna的释放行为都是ph敏感型,在酸性环境下的释放量和释放速度都明显高于和快于碱性环境中。
本发明与现有技术相比,所制备的药物载体具有无毒、生物相容性好、形态结构稳定,纳米粒粒径分布区间为89-183nm,平均粒径约为109nm,有利于穿透肿瘤组织;高的载药量和包封率,能有效包载疏水性抗肿瘤药物。通过季铵化淀粉的阳离子基团和sirna上的磷酸基团发生静电吸附作用,有效包载sirna,并在血液中有效保护sirna的完整性。药物和sirna共载体对肿瘤组织具有主动靶向输送作用,解决了小分子抗肿瘤药物和sirna没有肿瘤组织靶向作用的难题,药物和sirna共载纳米粒可以较长时间滞留肿瘤组织,长时间释放药物和sirna,可实现药物和sirna对肿瘤组织的联合治疗,同时降低对正常组织的毒副作用。
附图说明
图1叶酸(a)、生物素(b)、季铵化淀粉(c)和叶酸-生物素-季铵化淀粉(d)的傅里叶红外光谱图
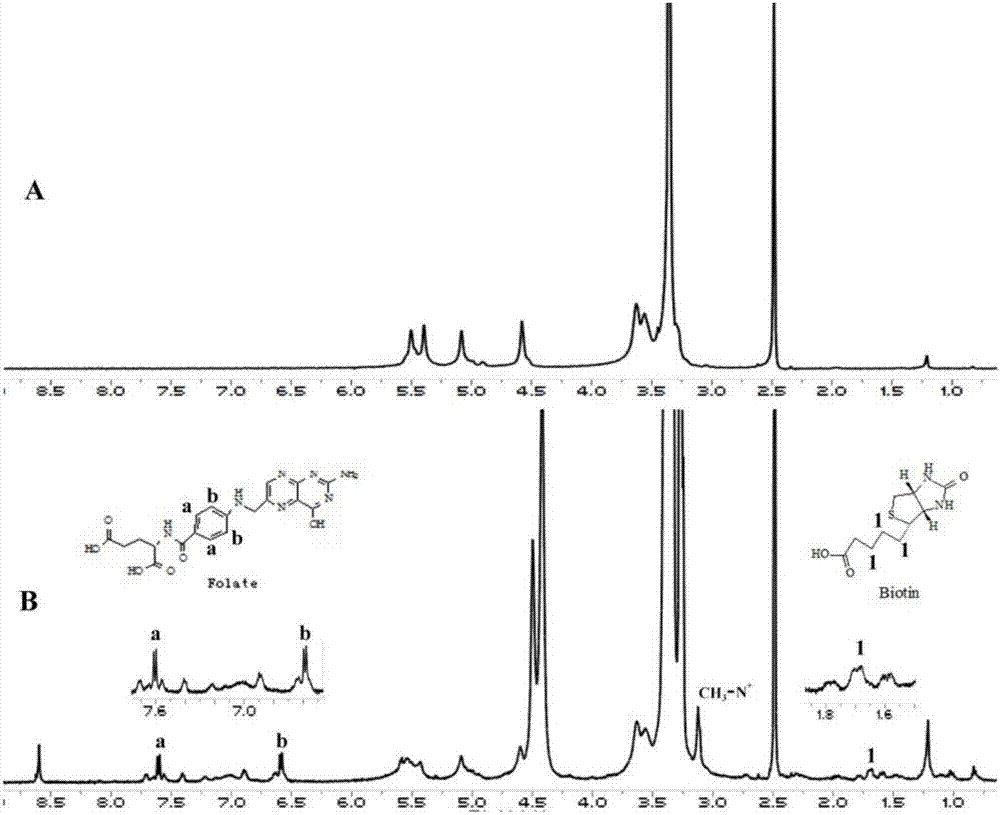
图2马铃薯淀粉(a)和叶酸-生物素-季铵化淀粉(b)的1h-nmr图谱。
图3实施例1所制的纳米微粒的电镜照片及粒径分布动态光散射图。
图4实施例1所制的纳米微粒的芘荧光光谱i386/i374的比值直线图(临界自聚浓度图)。
图5不同载体/药物质量比下实施例5所制的叶酸-生物素-季铵化淀粉纳米微粒的dox载药量和包封率示意图。
图6不同载药纳米粒/sirnasur质量比下实施例6所制的载药叶酸-生物素-季铵化淀粉纳米微粒和游离sirnasur链接能力凝胶电泳图。
图7实施例6所制的sirnasur和药物共载的叶酸-生物素-季铵化淀粉纳米微粒与裸sirnasur的血清稳定性凝胶电泳图。
图8不同ph条件下实施例6所制的sirnasur和阿霉素共载的叶酸-生物素-季铵化淀粉纳米微粒的dox(a)和sirnasur累积释放图(b)。
具体实施例
下面结合实施例对本发明作详细的说明。
本发明的高速搅拌是指搅拌速度为800-1000转/分钟。
实施例1:
叶酸-生物素-季铵化淀粉纳米微粒制备
实验原理如下,
具体制备方法如下:
a)季铵化淀粉的制备步骤:
20克马铃薯淀粉充分浸润于12ml异丙醇中,形成淀粉异丙醇溶液;
将5.925克naoh溶于8.24克去离子水中,形成naoh溶液,再将38.7克60%wt.的醚化剂cta倒入naoh溶液中,高速搅拌15分钟,生成2,3-环氧丙基三甲基氯化铵(gta)溶液;
将生成的2,3-环氧丙基三甲基氯化铵(gta)倒入淀粉异丙醇溶液中在室温的条件下,高速搅拌1小时,得到混合物,将混合物被密封置于65℃反应4小时,冷却至室温即生成白色季铵化淀粉初产物,加入无水乙酸中和至ph6-8,再通过真空抽滤将季铵化淀粉初产物用无水乙醇洗涤,直至滤液中滴入硝酸银没有氯化银沉淀即可,抽滤产物置于35℃烘箱干燥至恒重,即得到季铵化淀粉。
b)纳米粒的制备步骤:包括b1酯化步骤、b2透析步骤、b3洗涤及干燥步骤,b4分散步骤;
所述的b1酯化步骤为将a步骤制备的4g季铵化淀粉、1.5g生物素、4g叶酸、4gn,n′-二环己基碳二亚胺、4gn-羟基琥珀酰亚胺和1.5g4-二甲氨基吡啶混合溶于150ml二甲亚砜,室温下搅拌24h,以dcc、nhs和dmap为脱水剂和催化剂,叶酸和生物素上的羧基分别被活化后脱掉氢氧键,季铵化淀粉的羟基脱掉氢键,叶酸、生物素和季铵化淀粉经催化发生酯化反应,生成叶酸-生物素-季铵化淀粉复合物(fbqs)。
所述的b2透析步骤为将b1酯化步骤所制装入分子截流量为8000-14000da的透析袋,浸入去离子水中透析3天,第一天每4小时换一次新鲜的去离子水,后面是一天换一次去离子水,透析产物取出进行真空抽滤;
所述的b3洗涤及干燥步骤为将b2透析步骤过滤好的叶酸-生物素-季铵化淀粉复合物用乙醚和去离子水交替洗涤3次,再通过烘箱35℃干燥至恒重;
所述的b4分散步骤为将0.2克b3洗涤及干燥步骤制备好的叶酸-生物素-季铵化淀粉复合物分散于200ml去离子水中,用探针型超声波仪在100w功率下超声处理3分钟,经0.22微米微孔过滤器过滤除去灰尘和其它杂质,得到叶酸-生物素-季铵化淀粉纳米粒悬浮滤液,通过真空冷冻干燥(真空度为1pa,温度为-50℃)得到纳米颗粒冻干粉。
实施例1所制的叶酸-生物素-季铵化淀粉表征:
在图1的叶酸-生物素-季铵化淀粉的傅里叶红外光图谱中,出现在1023cm-1和1152cm-1处的吸收带是淀粉骨架的特征峰,在1510cm-1和2933cm-1处的吸收带是淀粉骨架上的季铵基团(c-n,c-h)特征峰。由于叶酸、生物素通过酯化反应成功与季铵化淀粉偶联,季铵化淀粉上的3200cm-1至3600cm-1区域平缓宽带在叶酸-生物素-季铵化淀粉的相同区域发生了显著增强,位于1685cm-1处的酰胺基伸缩带被观察到,1727cm-1处的碳氧双键(c=o)特征峰也被明显增强,1558cm-1和1606cm-1处的弯曲震动带是n-h键特征峰,根据以上数据结果初步证实叶酸-生物素-季铵化淀粉被成功合成。
叶酸-生物素-季铵化淀粉的1h-nmr谱图(图2)上,6.60ppm(b)和7.60ppm(a)处的特征峰归属于叶酸苯环上的氢原子,1.55-1.85ppm区域内的特征峰归属于生物素亚甲基上的氢原子,3.12ppm处的单峰是淀粉骨架上的季铵化基团(ch3-n+)的甲基氢原子特征峰,以上结果进一步证实叶酸和生物素被链接到季铵化淀粉上。
图3的透射电子显微镜照片显示:叶酸-生物素-季铵化淀粉纳米微粒为表面光滑、粒径均匀的球形结构,其动态光散射法测定的实施例1的纳米粒粒径分布区间为89-183nm,平均粒径约为109nm。
图4为不同浓度的叶酸-生物素-季铵化淀粉纳米微粒的芘荧光光谱i386/i374的比值直线图,以芘为荧光探针,当叶酸-生物素-季铵化淀粉溶液浓度高于其临界自组装浓度时,芘的荧光光谱在386nm处的吸光度值有很大增加,而此时374nm处的吸光度值无明显变化,因此本实验中用i386/i374的比值来确定叶酸-生物素-季铵化淀粉的临界自组装浓度。图4显示,叶酸-生物素-季铵化淀粉纳米微粒的临界自组装浓度为33mg/ml。
所制备的药物载体的季铵盐的取代度为0.59,叶酸根的取代度为0.64,生物素根的取代度为0.72。
实施例2:
叶酸-生物素-季铵化淀粉纳米微粒制备
具体制备方法如下:
a)季铵化淀粉的制备步骤:
20克天然马铃薯淀粉充分浸润于16ml异丙醇中,形成淀粉异丙醇溶液;
将5.925克naoh溶于8.24克去离子水中,形成naoh溶液,再将38.7克60%wt.的醚化剂cta倒入naoh溶液中,高速搅拌15分钟,生成2,3-环氧丙基三甲基氯化铵(gta)溶液;
将生成的2,3-环氧丙基三甲基氯化铵(gta)倒入淀粉异丙醇溶液中在室温的条件下,高速搅拌1小时,得到混合物,将混合物被密封置于65℃反应4小时,冷却至室温即生成白色季铵化淀粉初产物,加入无水乙酸中和至ph6-8,再通过真空抽滤将季铵化淀粉初产物用无水乙醇洗涤,直至滤液中滴入硝酸银没有氯化银沉淀即可。抽滤产物置于35℃烘箱干燥至恒重,即得到季铵化淀粉。
b)纳米粒的制备步骤:包括b1酯化步骤、b2透析步骤、b3洗涤及干燥步骤,b4分散步骤;
所述的b1酯化步骤为将a步骤制备的3g季铵化淀粉、1.5g生物素、3g叶酸、3gn,n′-二环己基碳二亚胺、3gn-羟基琥珀酰亚胺和1.5g4-二甲氨基吡啶混合溶于150ml二甲亚砜,室温下搅拌24h,以dcc、nhs和dmap为脱水剂和催化剂,叶酸和生物素上的羧基分别被活化后脱掉氢氧键,季铵化淀粉的羟基脱掉氢键,叶酸、生物素和季铵化淀粉经催化发生酯化反应,生成叶酸-生物素-季铵化淀粉复合物(fbqs)。
所述的b2透析步骤为将b1酯化步骤所制装入分子截流量为8000-14000da的透析袋,浸入去离子水中透析3天,第一天每4小时换一次新鲜的去离子水,后面是一天换一次去离子水,透析产物取出进行真空抽滤;
所述的b3洗涤及干燥步骤为将b2透析步骤过滤好的叶酸-生物素-季铵化淀粉复合物用乙醚和去离子水交替洗涤3次,再通过烘箱35℃干燥至恒重;
所述的b4分散步骤为将0.2克b3洗涤及干燥步骤制备好的叶酸-生物素-季铵化淀粉复合物分散于200ml去离子水中,用探针型超声波仪在100w功率下超声处理3分钟,经0.22微米微孔过滤器过滤除去灰尘和其它杂质,得到叶酸-生物素-季铵化淀粉纳米粒悬浮滤液,通过真空冷冻干燥(真空度为1pa,温度为-50℃)得到纳米颗粒冻干粉。
实施例3:
叶酸-生物素-季铵化淀粉纳米微粒制备
具体制备方法如下:
a)季铵化淀粉的制备步骤:
20克天然马铃薯淀粉充分浸润于20ml异丙醇中,形成淀粉异丙醇溶液;
将5.925克naoh溶于8.24克去离子水中,形成naoh溶液,再将38.7克60%wt.的醚化剂cta倒入naoh溶液中,高速搅拌15分钟,生成2,3-环氧丙基三甲基氯化铵(gta)溶液;
将生成的2,3-环氧丙基三甲基氯化铵(gta)倒入淀粉异丙醇溶液中在室温的条件下,高速搅拌1小时,得到混合物,将混合物被密封置于65℃反应4小时,冷却至室温即生成白色季铵化淀粉初产物,加入无水乙酸中和至ph6-8,再通过真空抽滤将季铵化淀粉初产物用无水乙醇洗涤,直至滤液中滴入硝酸银没有氯化银沉淀即可。抽滤产物置于35℃烘箱干燥至恒重,即得到季铵化淀粉。
b)纳米粒的制备步骤:包括b1酯化步骤、b2透析步骤、b3洗涤及干燥步骤,b4分散步骤;
所述的b1酯化步骤为将a步骤制备的3g季铵化淀粉、2g生物素、2.5g叶酸、2.5gn,n′-二环己基碳二亚胺、3gn-羟基琥珀酰亚胺和1.5g4-二甲氨基吡啶混合溶于150ml二甲亚砜,室温下搅拌24h,以dcc、nhs和dmap为脱水剂和催化剂,叶酸和生物素上的羧基分别被活化后脱掉氢氧键,季铵化淀粉的羟基脱掉氢键,叶酸、生物素和季铵化淀粉经催化发生酯化反应,生成叶酸-生物素-季铵化淀粉复合物(fbqs)。
所述的b2透析步骤为将b1酯化步骤所制装入分子截流量为8000-14000da的透析袋,浸入去离子水中透析3天,第一天每4小时换一次新鲜的去离子水,后面是一天换一次去离子水,透析产物取出进行真空抽滤;
所述的b3洗涤及干燥步骤为将b2透析步骤过滤好的叶酸-生物素-季铵化淀粉复合物用乙醚和去离子水交替洗涤3次,再通过烘箱35℃干燥至恒重;
所述的b4分散步骤为将0.2克b3洗涤及干燥步骤制备好的叶酸-生物素-季铵化淀粉复合物分散于200ml去离子水中,用探针型超声波仪在100w功率下超声处理3分钟,经0.22微米微孔过滤器过滤除去灰尘和其它杂质,得到叶酸-生物素-季铵化淀粉纳米粒悬浮滤液,通过真空冷冻干燥(真空度为1pa,温度为-50℃)得到纳米颗粒冻干粉。
实施例4:
载药叶酸-生物素-季铵化淀粉纳米粒制备
叶酸-生物素-季铵化淀粉纳米粒用于包载抗肿瘤药物的制备方法为:阿霉素(dox)为抗瘤谱较广的肿瘤临床治疗使用的疏水性药物,以其为例进行叶酸-生物素-季铵化淀粉纳米粒的载药制备。
盐酸阿霉素20mg与其3倍摩尔量的三乙胺混合并溶解于10ml的体积浓度为99%二甲基乙酰胺溶液中,形成盐酸阿霉素溶液。将实施例1所制的叶酸-生物素-季铵化淀粉纳米粒0.2克分散于200ml去离子水中,在室温、探针型超声波仪在100w功率超声的条件下,将盐酸阿霉素溶液滴入叶酸-生物素-季铵化淀粉纳米粒溶液中,滴加完成后,再超声处理3分钟。超声完毕后,将上述混合溶液保存在4℃中静置反应48h,然后将混合溶液置于透析袋(分子截流量为8000-14000da)中,在1/15m,ph7.4的磷酸盐缓冲液中室温下透析3天,第一天新鲜的磷酸盐缓冲液每4小时更换一次,其后每天更换一次,将透析产物通过孔径为0.22μm微孔滤膜去除有机溶剂和游离阿霉素,收集清澈载药纳米粒悬浮溶液,真空冷冻干燥(真空度为1pa,温度为-50℃)即得到载药叶酸-生物素-季铵化淀粉纳米粒冻干粉;
实施例5
称取5mg的盐酸阿霉素与其3倍摩尔量的三乙胺一同溶于2ml的二甲基乙酰胺溶液中,该溶液制备完全相同的5份。分别将叶酸-生物素-季铵化淀粉纳米粒冻干粉20mg,40mg,60mg,80mg,100mg分散于8ml去离子水,将上述5份相同的阿霉素溶液分别滴加到不同的5份纳米粒悬浮液中,均超声处理3分钟,制备成载药(阿霉素)叶酸-生物素-季铵化淀粉纳米粒dox0,dox1,dox2,dox3,dox4。将上述溶液保存在4℃中静置反应48h,然后将混合溶液置于透析袋(分子截流量为8000-14000da)中,在1/15m,ph7.4的磷酸盐缓冲液中室温下透析3天,第一天新鲜的磷酸盐缓冲液每4小时更换一次,其后每天更换一次,将透析产物通过孔径为0.22μm微孔滤膜去除有机溶剂和游离阿霉素,收集清澈载药纳米粒悬浮溶液,真空冷冻干燥(真空度为1pa,温度为-50℃)即得到5份冻干的载药叶酸-生物素-季铵化淀粉纳米粒dox0,dox1,dox2,dox3,dox4。
将5份冻干的载药纳米粒dox0,dox1,dox2,dox3,dox4分散于去离子水中,分别在室温下用探针型超声波仪100w功率超声3分钟,再经12000rmp高速离心15min,取每份样品的上清液,以去离子水为空白对照,用紫外分光光度法在490nm处测定吸光值。根据事先测得的阿霉素标准曲线(y=10.64x+0.0067,r2=0.9996),计算包载的药物含量,然后再分别计算5份样品的载药纳米粒的载药量与药物包封率:
实验测得增加阿霉素对纳米载体的质量比,阿霉素的载药量增加,但包封率下降(见图5)。实施例1所制的叶酸-生物素-季铵化淀粉纳米粒对阿霉素的载药量为4-12%,药物包封率为63-77%。
实施例6:
除化疗药物为紫杉醇外,其余与实施例4相同。实验测得叶酸-生物素-季铵化淀粉纳米粒对紫杉醇的载药量为3-9%,药物包封率为59-66%。
实施例7:
药物和sirnasur共载叶酸-生物素-季铵化淀粉纳米粒制备
研究表明survivin是迄今发现最强的肿瘤细胞凋亡抑制因子,直接抑制半胱氨酸蛋白酶caspase-3和caspase-7的活性,以survivin为癌症基因治疗靶基因,联系国内生物基因公司合成survivin的sirnasur基因序列5’-gaacaucaucauccaggac-3’和fam-sirnasur(fam:羧基荧光素)。将1mgsirnasur与40mg载药叶酸-生物素-季铵化淀粉纳米粒(实施例4)混合悬浮于10ml焦碳酸二乙酯处理过的灭菌水中,混合震荡15min,静置30min,12000rmp高速离心15min。去掉上清液,将底部沉淀物真空冷冻干燥,(真空度为1pa,温度为-50℃),得到sirnasur和抗癌药物共同包载的叶酸-生物素-季铵化淀粉纳米粒冻干粉,以上过程尽量保持无菌操作。
实施例8:
除小分子干扰rna的靶基因为bcl-2外,其它与实施例7相同。
bcl-2也是一种抑制细胞凋亡的癌基因,以bcl-2为癌症基因治疗靶基因,联系国内生物基因公司合成bcl-2的sirna基因序列(sirnabcl-2):5’-guacauccauuauaagcugdtdt-3’。
实施例9:
载药叶酸-生物素-季铵化淀粉纳米粒的sirnasur链接能力
为研究载药叶酸-生物素-季铵化淀粉纳米粒的sirna链接能力,用不同纳米粒(实施例4)和sirnasur的质量比(从10/1到60/1)配制药物和sirnasur共载叶酸-生物素-季铵化淀粉纳米粒,离心取上清液进行琼脂糖凝胶电泳成像(见图6),结果显示当载药叶酸-生物素-季铵化淀粉纳米粒和sirnasur的质量比达到40/1及以上时,游离的sirnasur完全被载药纳米粒包载。
实施例10:
sirnasur和sirna共载叶酸-生物素-季铵化淀粉纳米粒的血清稳定性
为了测定sirnasur和sirna共载叶酸-生物素-季铵化淀粉纳米粒的血清稳定性,将sirnasur和sirnasur共载叶酸-生物素-季铵化淀粉纳米粒(实施例7)悬浮于50%血清浓度的培养基中,于每个预定时间取出3ml样品,加入十二烷基硫酸钠终止核糖核酸酶活性并置换出被纳米粒包载的sirnasur,高速离心后取上清液冻存于-80℃冰箱。当所有预定时间的样品上清液均取出后,通过琼脂糖凝胶电泳实验,观察样品中sirnasur的完整性,图7显示被叶酸-生物素-季铵化淀粉纳米粒包载的sirnasur(实施例7)能够在血清中保持较好的完整性和稳定性。
实施例11:
阿霉素和sirnasur共载叶酸-生物素-季铵化淀粉纳米粒的药物(实施例7)和sirnasur释放
称取3份44mg的盐酸阿霉素和fam-sirnasur共载叶酸-生物素-季铵化淀粉纳米粒,分别悬浮于3份ph为5.3、6.5和7.4的44ml磷酸盐缓冲液中。每一份悬浮溶液均被等体积(4ml)分装和密封与11个离心管中,在37℃下温和震荡。于每一个预定的时间,在三组样品中每组取出一个样品,高速离心后取出上清液,用荧光分光光度法测定上清液中阿霉素和fam-sirnasur的吸光值并计算其浓度。阿霉素和fam-sirnasur的荧光发射波长分别是590nm和518nm,激发波长分别是480nm和492nm,计算出不同时间段的阿霉素和fam-sirnasur累计释放量并对应时间作图。图8显示了不同ph(5.3、6.5、7.4)条件下,被纳米粒包载的药物(实施例7)和fam-sirnasur释放行为均为ph敏感型。在正常生理环境下(ph7.4)阿霉素和fam-sirnasur的累积释放量较少,释放速率较缓慢,而在肿瘤的酸性环境下(ph5.3)阿霉素和fam-sirnasur的累积释放量很大,且释放速度明显加快。
以上实验结果表明本发明制备的叶酸-生物素-季铵化淀粉纳米粒形态结构稳定,临界自组装浓度低,制作简单。能有效包载疏水性小分子化疗药物和sirna,具有肿瘤组织主动靶向作用,血液中能有效保护sirna的完整性。本发明对实现肿瘤组织化疗和基因治疗的联合疗效有良好的应用前景,解决了临床使用的疏水性抗肿瘤药物难溶于水以及药物和sirna没有肿瘤组织靶向作用的难题,即能增强抗肿瘤药物和sirna对肿瘤组织的疗效,也可以减少抗肿瘤药物和sirna的用量,降低对正常组织的毒副作用。
- 还没有人留言评论。精彩留言会获得点赞!
- 靶向PD-1的多肽及其应用的制造方法与工艺
- 靶向同位素生产系统的制造方法与工艺
- 在制备68GA‑螯合物官能化的靶向剂中用作金属抑制剂的单糖、二糖或多糖的制造方法与工艺
- 用于引导和靶向按需物质递送的纳米结构的载体的制造方法与工艺
- 通过PROSTRATIN靶向K‑RAS介导的信号转导通路和恶性肿瘤的制造方法与工艺
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺