一种PD-L1抗体及其制备方法与流程
本发明涉及生物医药领域,具体涉及一种pd-l1抗体及其制备方法。
背景技术:
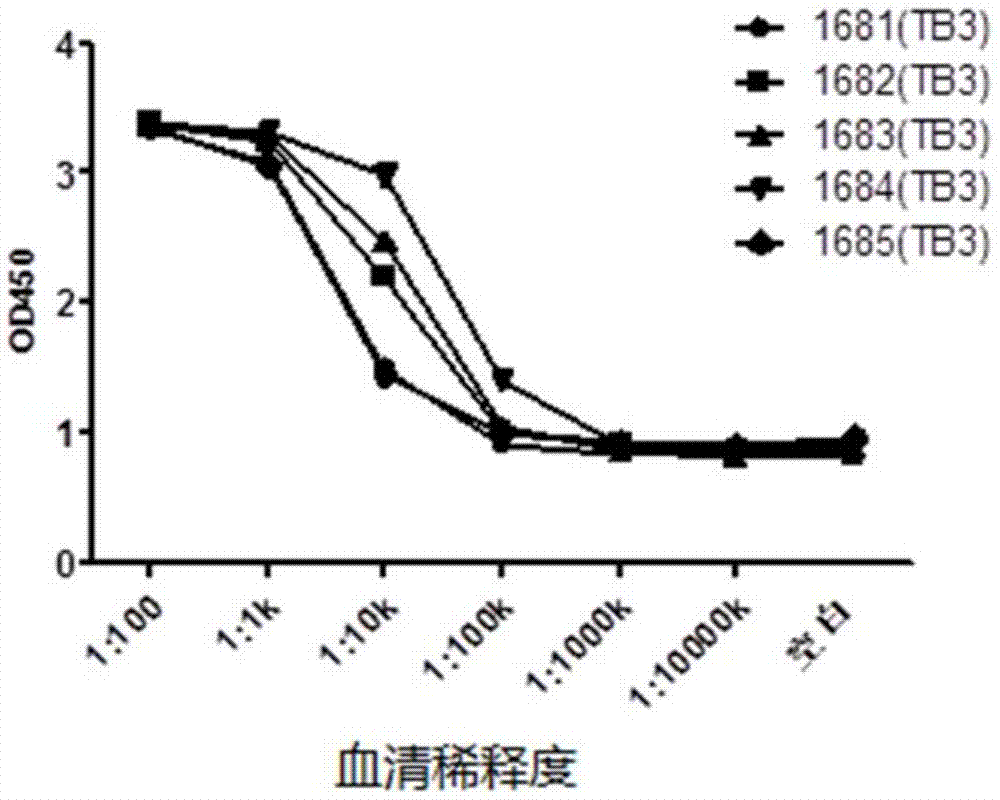
:pd-l1(b7h1),是b7家族的成员之一,是一个阅读框含有290个氨基酸的i型跨膜蛋白,由免疫球蛋白v-like、c-like区域、疏水跨膜区及c端胞内区组成(dongh,zhug,tamadak,chenl.naturemed.1999;5:1365–1369),其基因位于人染色体的9p24位点。pd-l1的rna转录分布广泛,在淋巴器官(如脾、骨髓、淋巴、胸腺)和非淋巴器官(如心脏、肌肉、胎盘、肺、肾脏、肝脏)中均被检测到。pd-l1在抗原递呈细胞,如巨噬细胞、树突状细胞表面呈组成型表达。并且,pd-l1在广泛的组织和细胞类型都能够表达,如在上皮细胞和内皮细胞中,可以被促炎症因子如ifn-γ等诱导表达。许多新鲜分离的肿瘤组织高表达pd-l1。pd-l1与恶性肿瘤的进程与预后相关。pd-l1的受体有二:一是pd-1,pd-1在活化的t细胞和b细胞上表达,也在活化的骨髓瘤细胞中表达。pd-1与pd-l1的结合可以抑制t细胞的增殖,激活下游抑制信号,从而使肿瘤细胞逃逸机体免疫系统的识别和攻击。体内实验表明,用可阻断pd-1与pd-l1结合的pd-1抗体或pd-l1抗体可使ctl细胞扩增,加速肿瘤缩小和病毒清除。pd-l1的另一受体是b7.1,b7.1在活化的t细胞有表达,作为pd-l1的抑制性受体,b7.1与pd-l1的结合可以激活下游抑制信号,抑制t细胞的增殖,体内表现为t细胞耐受的形成。最近研究表明,一些慢性病毒感染和癌症通过造成pd-1/pd-l1介导的t细胞耗竭来实现免疫逃逸。许多人源肿瘤细胞和肿瘤相关抗原呈递细胞高水平表达pd-l1,从而逃避抗肿瘤免疫反应(shengyao,yuwenzhu,andliepingchen,natrevdrugdiscov.2013february;12(2):130–146)。慢性hiv感染过程中,hiv特异性cd8+t细胞功能受损,产生细胞因子和效应分子能力降低,增殖能力减弱。有研究表明,在hiv感染个体中,hiv特异性cd8+t细胞中pd-1高表达,提示阻断pd-1/pd-l1通路提供了治疗hiv感染和艾滋病患者的潜在治疗方法(bowersnl,heltones,huijbregtsrph,etal.plospathog.2014march;10(3):e1003993)。总之,阻断pd-1/pd-l1通路的药物为多种癌症,hiv感染以及其他疾病和与t细胞耗竭相关的情况提供了新的治疗方法。因此,迫切需要可阻断pd-1/pd-l1通路的药物,如pd-l1抗体,尤其是人源化的pd-l1抗体,用于疾病治疗。技术实现要素:本发明所要解决的技术问题是为了克服目前缺少pd-l1抗体,尤其是人源化pd-l1抗体的不足,提供一种亲和力高、特异性强的pd-l1抗体及其制备方法。所述的pd-l1抗体与人源和猴源的pd-l1蛋白均具有高度亲和力,能够抑制pd-l1与其受体pd-1和b7.1的结合,能在人混合淋巴细胞或t淋巴细胞反应中显著增加ifn-γ和il-2的表达水平,并且缺乏与人pd-l2等同类蛋白抗原的交叉反应。本发明先制备人源pd-l1作为免疫原,采用人源抗体转基因小鼠技术进行全人源抗体的制备[lonberg,etal.1994,nature368(6474):856-859,lonberg,n.andhuszar,d.1995,intern.rev.immunol.13:65-93,andharding,f.andlonberg,n.,1995,ann.n.y.acad.sci.764:536-546],获得pd-l1抗体的先导抗体。再通过对先导抗体的初步生产、纯化和检定,获得具备抗体亲和力高(亲和力kd<1*10-9m)、有效封闭pd-l1与受体pd-1和b7.1的结合、在人混合淋巴细胞或t淋巴细胞反应中显著增加ifn-γ和il-2的表达水平、与人pd-l2等同类蛋白抗原缺乏交叉反应等优异生物性特性的pd-l1抗体。然后通过分子生物学方法测序获知pd-l1抗体的重链可变区和轻链可变区的氨基酸序列。本发明提供一种分离的蛋白质,其包括pd-l1抗体的重链cdr1、重链cdr2和重链cdr3中的一种或多种,和/或,pd-l1抗体的轻链cdr1、轻链cdr2和轻链cdr3中的一种或多种,所述重链cdr1的氨基酸序列如序列表中seqidno.2、seqidno.10、seqidno.18或seqidno.26所示;所述重链cdr2的氨基酸序列如序列表seqidno.3、seqidno.11、seqidno.19或seqidno.27所示;所述重链cdr3的氨基酸序列如序列表中seqidno.4、seqidno.12、seqidno.20或seqidno.28所示;所述轻链cdr1的氨基酸序列如序列表中seqidno.6、seqidno.14、seqidno.22或seqidno.30所示;所述轻链cdr2的氨基酸序列如序列表中seqidno.7、seqidno.15、seqidno.23或seqidno.31所示;所述轻链cdr3的氨基酸序列如序列表中seqidno.8、seqidno.16、seqidno.24或seqidno.32所示;或者,所述重链cdr1的氨基酸序列与如序列表中seqidno.2、seqidno.10、seqidno.18或seqidno.26所示的氨基酸序列至少有80%的序列同源性的氨基酸序列所示;所述重链cdr2的氨基酸序列与如序列表中seqidno.3、seqidno.11、seqidno.19或seqidno.27所示的氨基酸序列至少有80%的序列同源性的氨基酸序列所示;所述重链cdr3的氨基酸序列与如序列表中seqidno.4、seqidno.12、seqidno.20或seqidno.28所示的氨基酸序列至少有80%的序列同源性的氨基酸序列所示;所述轻链cdr1的氨基酸序列与如序列表中seqidno.6、seqidno.14、seqidno.22或seqidno.30所示的氨基酸序列至少有80%的序列同源性的氨基酸序列所示;所述轻链cdr2的氨基酸序列与如序列表中seqidno.7、seqidno.15、seqidno.23或seqidno.31所示的氨基酸序列至少有80%的序列同源性的氨基酸序列所示;所述轻链cdr3的氨基酸序列与如序列表中seqidno.8、seqidno.16、seqidno.24或seqidno.32所示的氨基酸序列至少有80%的序列同源性的氨基酸序列所示。较佳地,所述重链cdr1的氨基酸序列如序列表seqidno.2所示,所述重链cdr2的氨基酸序列如序列表seqidno.3所示且所述重链cdr3的氨基酸序列如序列表seqidno.4所示;所述重链cdr1的氨基酸序列如序列表seqidno.10所示,所述重链cdr2的氨基酸序列如序列表seqidno.11所示且所述重链cdr3的氨基酸序列如序列表seqidno.12所示;所述重链cdr1的氨基酸序列如序列表seqidno.18所示,所述重链cdr2的氨基酸序列如序列表seqidno.19所示且所述重链cdr3的氨基酸序列如序列表seqidno.20所示;所述重链cdr1的氨基酸序列如序列表seqidno.26所示,所述重链cdr2的氨基酸序列如序列表seqidno.27所示且所述重链cdr3的氨基酸序列如序列表seqidno.28所示;所述轻链cdr1的氨基酸序列如序列表seqidno.6所示,所述轻链cdr2的氨基酸序列如序列表seqidno.7所示且所述轻链cdr3的氨基酸序列如序列表seqidno.8所示;所述轻链cdr1的氨基酸序列如序列表seqidno.14所示,所述轻链cdr2的氨基酸序列如序列表seqidno.15所示且所述轻链cdr3的氨基酸序列如序列表seqidno.16所示;所述轻链cdr1的氨基酸序列如序列表seqidno.22所示,所述轻链cdr2的氨基酸序列如序列表seqidno.23所示且所述轻链cdr3的氨基酸序列如序列表seqidno.24所示;或,所述轻链cdr1的氨基酸序列如序列表seqidno.30所示,所述轻链cdr2的氨基酸序列如序列表seqidno.31所示且所述轻链cdr3的氨基酸序列如序列表seqidno.32所示。本发明提供一种分离的蛋白质,其包括pd-l1抗体的重链可变区和/或pd-l1抗体的轻链可变区,所述重链可变区的氨基酸序列如序列表中seqidno.1、seqidno.9、seqidno.17或seqidno.25所示;所述轻链可变区的氨基酸序列如序列表中seqidno.5、seqidno.13、seqidno.21或seqidno.29所示。较佳地,所述重链可变区的氨基酸序列如序列表seqidno.1所示且所述轻链可变区的氨基酸序列如序列表seqidno.5所示;所述重链可变区的氨基酸序列如序列表seqidno.9所示且所述轻链可变区的氨基酸序列如序列表seqidno.13所示;所述重链可变区的氨基酸序列如序列表seqidno.17所示且所述轻链可变区的氨基酸序列如序列表seqidno.21所示;或,所述重链可变区的氨基酸序列如序列表seqidno.25所示且所述轻链可变区的氨基酸序列如序列表seqidno.29所示。综上所述,上述氨基酸序列的编号如表1所示:表1pd-l1抗体蛋白序列编号其中,表1中的数字即为序列表“seqidno.”编号,如78b2d7的重链蛋白可变区的氨基酸序列为序列表seqidno.1,而78b2d7的重链蛋白可变区中cdr1域的氨基酸序列为序列表seqidno.2。较佳地,所述的蛋白质还包括抗体重链恒定区和/或抗体轻链恒定区,所述的抗体重链恒定区为本领域常规,较佳地为大鼠源抗体重链恒定区或人源抗体重链恒定区,更佳地为人源抗体重链恒定区。所述的抗体轻链恒定区为本领域常规,较佳地为大鼠源轻链抗体恒定区或人源抗体轻链恒定区,更佳地为人源抗体轻链恒定区。所述的蛋白质为本领域常规的蛋白质,较佳地为pd-l1抗体,更佳地为抗体全长蛋白、抗原抗体结合域蛋白质片段、双特异性抗体、多特异性抗体、单链抗体(singlechainantibodyfragment,scfv)、单域抗体(single-domainantibody,sdab)和单区抗体(signle-domainantibody)中的一种或多种,以及上述抗体所制得的单克隆抗体或多克隆抗体。所述单克隆抗体可以由多种途径和技术进行研制,包括杂交瘤技术、噬菌体展示技术、单淋巴细胞基因克隆技术等,主流是通过杂交瘤技术从野生型或转基因小鼠制备单克隆抗体。所述的抗体全长蛋白为本领域常规的抗体全长蛋白,其包括重链可变区、轻链可变区、重链恒定区和轻链恒定区。所述的蛋白质的重链可变区和轻链可变区与人源重链恒定区和人源轻链恒定区构成全人源抗体全长蛋白。较佳地,所述的抗体全长蛋白为igg1、igg2、igg3或igg4。所述的单链抗体为本领域常规的单链抗体,其包括重链可变区、轻链可变区和15~20个氨基酸的短肽。所述的抗原抗体结合域蛋白质片段为本领域常规的抗原抗体结合域蛋白质片段,其包括轻链可变区、轻链恒定区和重链恒定区的fd段。较佳地,所述的抗原抗体结合域蛋白质片段为fab和f(ab’)。所述的单域抗体为本领域常规的单域抗体,其包括重链可变区和重链恒定区。所述的单区抗体为本领域常规的单区抗体,其仅包括重链可变区。其中,所述蛋白质的制备方法为本领域常规的制备方法。所述制备方法较佳地为:从重组表达该蛋白质的表达转化体中分离获得或者通过人工合成蛋白质序列获得。所述的从重组表达该蛋白质的表达转化体中分离获得优选如下方法:将编码所述蛋白质并且带有点突变的核酸分子克隆到重组载体中,将所得重组载体转化到转化体中,得到重组表达转化体,通过培养所得重组表达转化体,即可分离纯化获得所述蛋白质。本发明还提供一种核酸,其编码上述的蛋白质。较佳地,编码所述重链可变区的核酸如序列表seqidno.33、序列表seqidno.34、序列表seqidno.35或序列表seqidno.36所示;和/或,编码所述轻链可变区的核酸的核苷酸序列如序列表seqidno.37、序列表seqidno.38、序列表seqidno.39或序列表seqidno.49所示。更佳地,编码所述重链可变区的核酸如序列表seqidno.33所示且编码所述轻链可变区的核酸如序列表seqidno.37所示;编码所述重链可变区的核酸如序列表seqidno.34所示且编码所述轻链可变区的核酸如序列表seqidno.38所示;编码所述重链可变区的核酸如序列表seqidno.35所示且编码所述轻链可变区的核酸如序列表seqidno.39所示;或,编码所述重链可变区的核酸如序列表seqidno.36所示且编码所述轻链可变区的核酸如序列表seqidno.40所示。上述核苷酸序列的编号如表2所示:表2pd-l1抗体基因序列编号克隆号重链蛋白可变区轻链蛋白可变区78b2d7333778a11f63438105c5d7353973d3g23640其中,表2中的数字即为序列表“seqidno.”编号,如编码78b2d7的重链蛋白可变区的核苷酸序列为序列表seqidno.33。其中,编码78b2d7的重链蛋白可变区中cdr1域的核苷酸序列为序列表seqidno.33中的第76位至第105位;编码78b2d7的重链蛋白可变区中cdr2域的核苷酸序列为序列表seqidno.33中的第148位至第198位;编码78b2d7的重链蛋白可变区中cdr3域的核苷酸序列为序列表seqidno.33中的第295位至第327位;编码78b2d7的轻链蛋白可变区中cdr1域的核苷酸序列为序列表seqidno.37中的第70位至第102位;编码78b2d7的轻链蛋白可变区中cdr2域的核苷酸序列为序列表seqidno.37中的第148位至第168位;编码78b2d7的轻链蛋白可变区中cdr3域的核苷酸序列为序列表seqidno.37中的第265位至第291位;编码78a11f6的重链蛋白可变区中cdr1域的核苷酸序列为序列表seqidno.34中的第76位至第105位;编码78a11f6的重链蛋白可变区中cdr2域的核苷酸序列为序列表seqidno.34中的第148位至第198位;编码78a11f6的重链蛋白可变区中cdr3域的核苷酸序列为序列表seqidno.34中的第295位至第330位;编码78a11f6的轻链蛋白可变区中cdr1域的核苷酸序列为序列表seqidno.38中的第70位至第102位;编码78a11f6的轻链蛋白可变区中cdr2域的核苷酸序列为序列表seqidno.38中的第148位至第168位;编码78a11f6的轻链蛋白可变区中cdr3域的核苷酸序列为序列表seqidno.38中的第265位至第291位;编码105c5d7的重链蛋白可变区中cdr1域的核苷酸序列为序列表seqidno.35中的第76位至第105位;编码105c5d7的重链蛋白可变区中cdr2域的核苷酸序列为序列表seqidno.35中的第148位至第198位;编码105c5d7的重链蛋白可变区中cdr3域的核苷酸序列为序列表seqidno.35中的第295位至第324位;编码105c5d7的轻链蛋白可变区中cdr1域的核苷酸序列为序列表seqidno.39中的第70位至第102位;编码105c5d7的轻链蛋白可变区中cdr2域的核苷酸序列为序列表seqidno.39中的第148.位至第168位;编码105c5d7的轻链蛋白可变区中cdr3域的核苷酸序列为序列表seqidno.39中的第265位至第291位;编码73d3g2的重链蛋白可变区中cdr1域的核苷酸序列为序列表seqidno.36中的第76位至第105位;编码73d3g2的重链蛋白可变区中cdr2域的核苷酸序列为序列表seqidno.36中的第148位至第198位;编码73d3g2的重链蛋白可变区中cdr3域的核苷酸序列为序列表seqidno.36中的第295位至第330位;编码73d3g2的轻链蛋白可变区中cdr1域的核苷酸序列为序列表seqidno.40中的第70位至第102位;编码73d3g2的轻链蛋白可变区中cdr2域的核苷酸序列为序列表seqidno.40中的第148位至第168位;编码73d3g2的轻链蛋白可变区中cdr3域的核苷酸序列为序列表seqidno.40中的第265位至第288位。所述核酸的制备方法为本领域常规的制备方法,较佳地,包括以下的步骤:通过基因克隆技术获得编码上述蛋白质的核酸分子,或者通过人工全序列合成的方法得到编码上述蛋白质的核酸分子。本领域技术人员知晓,编码上述蛋白质的氨基酸序列的碱基序列可以适当引入替换、缺失、改变、插入或增加来提供一个多聚核苷酸的同系物。本发明中多聚核苷酸的同系物可以通过对编码该蛋白序列基因的一个或多个碱基在保持抗体活性范围内进行替换、缺失或增加来制得。本发明还提供一种包含所述核酸的重组表达载体。其中所述重组表达载体可通过本领域常规方法获得,即:将本发明所述的核酸分子连接于各种表达载体上构建而成。所述的表达载体为本领域常规的各种载体,只要其能够容载前述核酸分子即可。所述载体较佳地包括:各种质粒、粘粒、噬菌体或病毒载体等。本发明还提供一种包含上述重组表达载体的重组表达转化体。其中,所述重组表达转化体的制备方法为本领域常规的制备方法,较佳地为:将上述重组表达载体转化至宿主细胞中制得。所述的宿主细胞为本领域常规的各种宿主细胞,只要能满足使上述重组表达载体稳定地自行复制,且所携带所述的核酸可被有效表达即可。较佳地,所述宿主细胞为e.colitg1或bl21细胞(表达单链抗体或fab抗体),或者cho-k1细胞(表达全长igg抗体)。将前述重组表达质粒转化至宿主细胞中,即可得本发明优选的重组表达转化体。其中所述转化方法为本领域常规转化方法,较佳地为化学转化法,热激法或电转法。本发明提供一种pd-l1抗体的制备方法,其包括如下步骤:培养上述的重组表达转化体,从培养物中获得pd-l1抗体。本发明还提供一种检测过表达pd-l1蛋白的细胞的方法,包括如下的步骤:上述的蛋白质与待检样品在体外接触,检测上述的蛋白质与所述待检样品的结合即可。所述的过表达的含义为本领域常规,指pd-l1蛋白在待检样品中的rna或蛋白质的过表达(由于转录增加、转录后加工、翻译、翻译后加工以及蛋白质降解改变),以及由于蛋白质运送模式改变(核定位增加)而导致的局部过表达和功能活性提高(如在底物的酶水解作用增加的情况下)。所述结合的检测方式是本领域常规的检测方式,较佳地为facs检测。本发明提供一种检测过表达pd-l1蛋白的细胞的组合物,其包括上述的蛋白质作为活性成分。较佳地,其还包括上述的蛋白质的功能片段组成的化合物作为活性成分。在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。本发明所用试剂和原料均市售可得。本发明的积极进步效果在于:本发明所述的蛋白质是一种全人源pd-l1抗体,其与pd-l1蛋白具有高度亲和力(亲和力kd<1*10-9m),能够结合pd-l1蛋白受体的胞外区,并能够在蛋白水平和细胞水平有效封闭pd-l1蛋白,阻止pd-l1蛋白与受体pd-1和b7.1的结合。所述的pd-l1抗体缺乏与人pd-l2等同类蛋白抗原的交叉反应。混合淋巴细胞实验和t细胞刺激实验证明,所述的pd-l1抗体具有良好的生物活性,其在人混合淋巴细胞或t淋巴细胞中会显著增加ifn-γ和il-2的表达量。由此可见,所述的pd-l1抗体除了为全人源序列外,还具有包括结合人pd-l1蛋白的高度特异性、能够调节人淋巴细胞免疫反应等优异的特性。附图说明图1为pd-l1-hfc蛋白与生物素标记的pd-1-hfc的结合活性。图2为pd-l1蛋白转染的hek293细胞facs筛选检测。图3为elisa检测pd-l1免疫后harbour转基因小鼠血清抗体效价情况。图4为elisa检测pd-l1抗体与人pd-l1-hfc蛋白的结合反应。图5为elisa检测pd-l1抗体与猴pd-l1-hfc蛋白的结合反应。图6为elisa检测pd-l1抗体与其他免疫检查点蛋白的结合反应。图7为facs检测pd-l1抗体与chok1-hpd-l1的结合反应。图8为facs检测pd-l1抗体与chok1-cpd-l1的结合反应。图9为pd-l1抗体阻断pd-l1蛋白与其受体pd-1的结合反应。图10为pd-l1抗体阻断pd-l1蛋白与其受体b7.1的结合反应。图11为pd-l1抗体在pbmc淋巴细胞刺激试验中对ifn-γ分泌的影响。图12为pd-l1抗体在混合淋巴细胞试验中对il-2分泌的影响(pbmc供体-1)。图13为pd-l1抗体在混合淋巴细胞试验中对il-2分泌的影响(pbmc供体-2)。图14为pd-l1抗体在混合淋巴细胞试验中对ifn-γ分泌的影响(pbmc供体-1)。图15为pd-l1抗体在混合淋巴细胞试验中对ifn-γ分泌的影响(pbmc供体-2)。图16为pd-l1抗体在混合淋巴细胞试验中对ifn-γ分泌的影响(pbmc供体-1)。图17为pd-l1抗体在混合淋巴细胞试验中对ifn-γ分泌的影响(pbmc供体-2)。图18为pd-l1抗体在混合淋巴细胞试验中对il-2分泌的影响(pbmc供体-1)。图19为pd-l1抗体在混合淋巴细胞试验中对il-2分泌的影响(pbmc供体-2)。图20为pd-l1抗体在混合淋巴细胞试验中对ifn-γ分泌的影响(pbmc供体-1)。图21为pd-l1抗体在混合淋巴细胞试验中对ifn-γ分泌的影响(pbmc供体-2)。图22为pd-l1全人源抗体阻断pd-l1蛋白与其受体pd-1的结合反应。图23为pd-l1全人源抗体阻断pd-l1蛋白与其受体b7.1的结合反应。图24为pd-l1全人源抗体在混合淋巴细胞试验中对il-2分泌的影响。图25为pd-l1全人源抗体在混合淋巴细胞试验中对il-2分泌的影响。图26为pd-l1全人源抗体在混合淋巴细胞试验中对ifn-γ分泌的影响。图27为pd-l1全人源抗体在混合淋巴细胞试验中对ifn-γ分泌的影响。具体实施方式下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。实施例中所述的室温为本领域常规的室温,一般为10~30℃。若无特别说明,实施例中所述的pbs为pbs磷酸缓冲液,ph7.2。实施例1pd-l1抗体的制备(一)、免疫原a的制备将人源pd-l1蛋白胞外区氨基酸序列phe19-thr239(如序列表seqidno.41所示)克隆到带有人iggfc片段(hfc)的pcpc载体(购自invitrogen,v044-50)并按已建立的标准分子生物学方法制备质粒,具体方法参见sambrook,j.,fritsch,e.f.,andmaniatist.(1989).molecularcloning:alaboratorymanual,secondedition(plainview,newyork:coldspringharborlaboratorypress)。对hek293细胞(购自invitrogen)进行瞬时转染(pei,polysciences)并使用freestyletm293(invitrogen)在37℃下进行扩大培养。4天后收集细胞培养液,离心去除细胞成分,得含pd-l1蛋白胞外区的培养上清液。将培养上清液上样到蛋白a亲和层析柱(mabselectsure,购自gehealthcare),同时用紫外(uv)检测仪监测紫外吸收值(a280nm)的变化。上样后用pbs磷酸盐缓冲液(ph7.2)清洗蛋白a亲和层析柱直到紫外吸收值回到基线,然后用0.1m甘氨酸盐酸(ph2.5)洗脱,收集从蛋白a亲和层析柱上洗脱下来的带hfc标签的pd-l1蛋白(pd-l1-hfc),用pbs磷酸盐缓冲液(ph7.2)在4℃冰箱透析过夜。透析后的蛋白经0.22微米无菌过滤后分装于-80℃保存,即获得纯化的免疫原a。免疫原a在使用前需要进行一系列质控检测,如检测其蛋白浓度、纯度、分子量和生物活性等,结果如图1和表3所示。表3说明pd-l1与pd-1在蛋白水平的结合随pd-1的浓度变化而变化,其中对照蛋白为非pd-l1融合蛋白,表中的数据为od450nm值。其中,免疫原a生物活性采用elisa检测,具体为:将带hfc标签的pd-1蛋白(pd-1-hfc)用pbs稀释至1μg/ml,以100μl/孔加入elisa微孔板,4℃孵育过夜。用elisa封闭液(含1%bsa,ph7.4的pbs磷酸缓冲液,所述百分比为质量百分比)37℃封闭两小时后,再加入梯度稀释的生物素标记的pd-l1-hfc(即免疫原a)37℃温育1小时。生物素标记的pd-l1-hfc的制备方法如下:将pd-l1-hfc与生物素化试剂反应即可。所述pd-1-hfc的制备方法与免疫原a的制备方法相同,其中pd-1胞外区蛋白(leu25-glu167)的氨基酸序列信息参见uniprot数据库,编号q15116;所述生物素化试剂购自sigma,商品号b3295;与生物素化试剂反应的操作步骤参见该生物素化试剂的说明书。加入链霉亲和素标记的辣根过氧化物酶(购自sigma商品号s2438),室温孵育30分钟后加入100微升/孔tmb显色液。室温孵育15分钟后,加入50微升1n盐酸终止显色反应,用elisa读板机读取od450nm读数。表3pd-l1-hfc蛋白与受体pd-1-hfc的结合活性(二)、免疫原b的制备人源pd-l1全长氨基酸序列(如序列表seqidno.42所示)被克隆到pires载体(购自clontech)并制备质粒。对hek293细胞系和chok1细胞系(均购自invitrogen)进行质粒转染(转染使用x-tremegenehpdnatransfectionreagent,购自roche公司,货号cat#06366236001,并按说明书操作)后,在含0.5μg/ml的含10%(w/w)fbs的dmem培养基中选择性培养2周,用有限稀释法在96孔培养板中进行亚克隆,并置于37℃,5%(v/v)co2培养。大约2周后选择部分单克隆孔扩增到6孔板中。对扩增后的克隆用已知的pd-l1抗体(购自r&dsystems)经流式细胞分析法进行筛选。选择长势较好、荧光强度较高、单克隆的细胞系继续扩大培养并液氮冻存,即获得免疫原b。具体选择结果如表4和图2所示,表4中阳性细胞(%)指阳性细胞占总细胞数目的百分比。表4说明,已经制得一系列pd-l1阳性表达的hek293细胞系。表4pd-l1蛋白转染的hek293细胞facs筛选检测结果(三)、免疫原c的制备人源pd-l1全长氨基酸序列cdna(如序列表seqidno.43所示)被克隆到pcdna3.1载体(购自invitrogen)并包被到1.0μm金胶体子弹(购自bio-rad),并用helios基因枪免疫(heliosgenegunsystem,bio-rad,货号165-2431),即得免疫原c。其中,包被到1.0μm金胶体子弹和免疫的方法参见helios基因枪说明书进行制备。(四)、杂交瘤细胞的制备和抗体筛选harbour转基因小鼠引入了人免疫球蛋白可变区基因和大鼠免疫球蛋白恒定区基因,而小鼠本身的ig表达则被沉默(f.g.franklin,etal,patent#wo2010/070263al)。该转基因小鼠经抗原免疫后能产生与正常小鼠(如balb/c)相当的免疫反应和抗体效价。a、免疫原a免疫采用6~8周龄harbour人源抗体转基因小鼠(购自北京维通利华公司),小鼠在spf条件下饲养。初次免疫时,免疫原(1)蛋白用弗氏完全佐剂乳化后腹腔注射0.25毫升,即每只小鼠注射100微克免疫原a蛋白。加强免疫时,免疫原a蛋白用弗氏不完全佐剂乳化后腹腔注射0.25毫升,即每只小鼠注射50微克免疫原a蛋白。初次免疫与第一次加强免疫之间间隔2周,以后每次加强免疫之间间隔3周。每次加强免疫1周后采血,用elisa和facs检测血清中免疫原(1)的抗体效价和特异性,结果如图3和表5所示。表5说明,经pd-l1-hfc免疫的小鼠的免疫后血清对免疫原均有不同程度的结合,呈现抗原抗体反应,其中最高稀释度在一百万左右。其中空白对照为1%(w/w)bsa,其中批次指第三次加强免疫后第七天的小鼠血清,表中的数据为od450nm值表5elisa检测pd-l1蛋白免疫后harbour转基因小鼠血清抗体效价b、免疫原b免疫采用6~8周龄harbour人源抗体转基因小鼠(购自北京维通利华公司),小鼠在spf条件下饲养。将按实施例1步骤(二)中的得到的含人源pd-l1的hek293-hpd-l1稳定细胞系在t-75细胞培养瓶中扩大培养至90%汇合度,吸尽培养基。用dmem基础培养基(购自invitrogen)洗涤2次,然后用无酶细胞解离液(购自invitrogen)37℃处理直至细胞从培养皿壁上可脱落,收集细胞。用dmem基础培养基洗涤2次,进行细胞计数后将细胞用磷酸盐缓冲液(ph7.2)稀释至2╳107细胞每毫升。每只小鼠每次免疫时腹腔注射0.5毫升细胞悬液。第一次与第二次免疫之间间隔2周,以后每次免疫间隔3周。除第一次免疫以外,每次免疫1周后采血,用facs检测血清中抗体效价和特异性。在二次加强免疫后,facs检测血清抗体效价通常达到1:1000以上。c、免疫原c免疫采用6~8周龄harbour人源抗体转基因小鼠(购自北京维通利华公司),小鼠在spf条件下饲养。所有小鼠经腹部用helios基因枪免疫4次,每次4枪,每枪1.0微克dna量。初次免疫与第一次加强免疫之间隔2周,以后每次加强免疫间隔3周。每次加强免疫1周后采血,用elisa或facs检测血清中抗体效价。在二次加强免疫后,facs检测血清抗体效价通常达到1:1000以上,elisa效价在1:10000以上。通常以免疫原a~c进行免疫,大部分小鼠经3次免疫后facs效价可达到1:1000以上。a~c步骤完成前,将所选择的每只小鼠最后一次免疫腹腔注射100微克纯化的pd-l1-hfc(针对免疫原a和免疫原c进行免疫反应的小鼠)或含人源pd-l1的hek293-hpd-l1稳定细胞系(针对免疫原b进行免疫反应的小鼠),5天后处死小鼠,收集脾细胞。加入nh4oh至终浓度1%(w/w),裂解脾细胞中参杂的红细胞,获得脾细胞悬液。用dmem基础培养基1000转每分钟离心清洗细胞3次,然后按活细胞数目5:1比率与小鼠骨髓瘤细胞sp2/0混合(购自atcc),采用高效电融合或peg方法(参见methodsinenzymology,vol.220)进行细胞融合。融合后的细胞稀释到含20%胎牛血清、1╳hat的dmem培养基中,所述百分比为质量百分比。然后按1╳105/20微升每孔加入到96孔细胞培养板中,放入5%co2、37℃培养箱中,所述百分比为体积百分比。14天后用elisa和acumen(微孔板细胞检测法)筛选细胞融合板上清,将elisa中od450nm>1.0和acumen中mfi值>100的阳性克隆扩增到24孔板,在含10%(w/w)胎牛血清的dmem(invitrogen)的培养基中,在37℃,5%(v/v)co2条件下扩大培养。培养3天后取24孔板中扩大培养的培养液进行离心,收集上清液,对上清液进行抗体亚型分析。用elisa、facs确定对pd-l1蛋白和pd-l1阳性细胞的结合活性(结合活性的检测方法请分别参见实施例3a和实施例3b),配体受体结合实验确定抗体样品对pd-l1受体的封闭活性(结合活性的检测方法请分别参见实施例4)。根据24孔板筛选结果,挑选elisa实验中od450nm>1.0、facs实验中mfi值>50和配体受体结合实验中杂交瘤细胞培养上清对pd-l1受体的封闭抑制率达到60%的杂交瘤细胞为符合条件的阳性克隆。选择符合条件的杂交瘤细胞用有限稀释法在96孔板进行亚克隆,在含10%(w/w)fbs的dmem培养基中(购自invitrogen)37℃,5%(v/v)co2条件下培养。亚克隆后10天用elisa和acumen进行初步筛选,挑选阳性单克隆扩增到24孔板继续培养。3天后用facs确定抗原结合阳性并用pd-l1受体配体结合实验评估生物活性(评估标准为elisa实验中od450nm>1.0、facs实验中mfi值>50和配体受体结合实验中杂交瘤细胞培养上清对pd-1受体的封闭抑制率达到60%)。根据24孔板样品检测结果,阳性克隆在含10%(w/w)fbs的dmem(购自invitrogen)培养基中,在37℃,5%(v/v)co2条件下进行扩大培养,细胞悬浮于冻存液[含有20%(w/w)fbs和10%(w/w)dmso的dmem]中,按常规方法液氮冻存即得本发明杂交瘤细胞,并可用于后续的抗体生产和纯化。实施例2先导抗体的生产和纯化杂交瘤细胞产生的抗体浓度较低,大约仅1-10μg/毫升,浓度变化较大。且培养基中细胞培养所产生的多种蛋白和培养基所含胎牛血清成分对很多生物活性分析方法都有不同程度的干扰,因此需要进行小规模(1-5毫克)抗体生产纯化。将实施例1所得的杂交瘤细胞扩增到t-75细胞培养瓶并用生产培养基(hybridomaserumfreemedium,购自invitrogen公司)驯化传代3代。待其生长状态良好,接种细胞培养转瓶。每个2升的培养转瓶中加入500毫升生产培养基,接种细胞密度为1.0╳105/毫升。盖紧瓶盖,将转瓶置于37℃培养箱中的转瓶机上,转速3转/分钟。连续旋转培养14天后,收集细胞培养液,过滤去除细胞,并用0.45微米的滤膜过滤至培养上清液澄清。澄清的培养上清液可马上进行纯化或-30℃冻存。澄清的杂交瘤细胞的培养上清液(300ml)中的单克隆抗体可用2ml蛋白g柱(购自gehealthcare)。蛋白g柱先用平衡缓冲液(pbs磷酸缓冲液,ph7.2)平衡,然后将澄清的培养上清液上样到蛋白g柱,控制流速在3ml/分钟。上样完毕后用平衡缓冲液清洗蛋白g柱,平衡缓冲液的体积为4倍蛋白g柱柱床体积。用洗脱液(0.1m甘氨盐酸缓冲液,ph2.5)洗脱结合在蛋白g柱上的pd-l1抗体,用紫外检测器监测洗脱情况(a280紫外吸收峰)。收集洗脱的抗体,加入10%1.0mtris-hcl缓冲液中和ph,所述百分比为体积百分比,然后立即用pbs磷酸缓冲液透析过夜,第二天换液1次并继续透析3小时。收集透析后的pd-l1抗体,用0.22微米的滤器进行无菌过滤,无菌保存,即得纯化的pd-l1抗体。将纯化的pd-l1抗体进行蛋白浓度(a280/1.4)、纯度、内毒(lonza试剂盒)等检测分析,结果如表6所示,结果发现,抗体最终产品内毒素浓度在1.0eu/毫克以内。表6纯化的pd-l1抗体检测分析实施例3先导抗体的检定a、酶联免疫吸附实验(elisa)检测抗体与pd-l1蛋白的结合对实施例2所得的纯化的pd-l1抗体进行与人pd-l1-hfc蛋白、与猴pd-l1-hfc和与pd-l1蛋白所在家族的其他免疫检测点蛋白pdl2-hfc分别进行交叉反应。将实施例1获得的纯化的免疫原a(pd-l1-hfc)、猴pd-l1-hfc[其制备方法参见实施例1步骤(一)免疫原a的制备,其中猴源pd-l1蛋白胞外区(phe19-thr239)氨基酸序列的数据库登录号为g7pse7]或其他免疫检测点蛋白pdl2-hfc(购自r&dsystems)分别用pbs稀释到终浓度1.0μg/ml,然后以100μl每孔加到96孔elisa板。用塑料膜封好4℃孵育过夜,第二天用洗板液[含有0.01%(v/v)tween20的pbs]洗板2次,加入封闭液[含有0.01%(v/v)tween20和1%(v/v)bsa的pbs]室温封闭2小时。倒掉封闭液,加入实施例2所得的纯化的pd-l1抗体100μl每孔。37℃孵育2小时后,用洗板液[含有0.01%(v/v)tween20的pbs]洗板3次。加入hrp(辣根过氧化物酶)标记的二抗(购自sigma),37℃孵育2小时后,用洗板液[含有0.01%(v/v)tween20的pbs]洗板3次。加入tmb底物100μl每孔,室温孵育30分钟后,加入终止液(1.0nhcl)100μl每孔。用elisa读板机(spectramax384plus,moleculardevice)读取a450nm数值,结果如图4~6和表7~9所示,表7~9说明,纯化后的抗体与pd-l1重组蛋白在elisa水平特异性结合。其中空白为人igg,pdl2-fc作为阴性对照(negativecontrol,nc),表中的数据为od450nm值。表7elisa检测pd-l1抗体与人pd-l1-hfc蛋白的结合反应表8elisa检测pd-l1抗体与猴pd-l1-hfc蛋白的结合反应表9elisa检测pd-l1抗体与其他免疫检查点蛋白的结合反应b、流式细胞实验(facs)检测抗体与pd-l1表达细胞的结合将实施例1步骤(二)中所述含有编码人源pd-l1全长氨基酸序列的核苷酸序列的pires质粒转染chok1细胞株得含人pd-l1的chok1稳转细胞株(此处称为chok1-hpd-l1稳定细胞株),将带有猴源pdl1全长基因的pires质粒(其制备方法与实施例1步骤(一)“免疫原a的制备”中带有人源iggfc片段(hfc)的pcpc载体的制备方法相同,其中猴源pd-l1蛋白胞外区(phe19-thr239)氨基酸序列的数据库登录号为g7pse7)转染chok1细胞株得含猴pd-l1的chok1稳转细胞株(此处称为chok1-cpd-l1稳定细胞株)。将chok1-hpd-l1稳定细胞株和chok1-cpd-l1稳定细胞株在t-75细胞培养瓶中扩大培养至90%汇合度,吸尽培养基,用hbss缓冲液(hanksbalancedsaltsolution,购自invitrogen)洗涤2次,然后用无酶细胞解离液(versenesolution,购自lifetechnology公司)处理和收集细胞。用hbss缓冲液洗涤细胞2次,进行细胞计数后将细胞用hbss缓冲液稀释至2╳106细胞每毫升,加入1%山羊血清封闭液,所述百分比为质量百分比。冰上孵育30分钟,然后用hbss缓冲液离心洗涤2次。将收集的细胞用facs缓冲液(含有1%bsa的hbss,所述百分比为质量百分比)悬浮至2╳106细胞/ml,按每孔100微升加入到96孔facs反应板中,加入实施例2所得的纯化的pd-l1抗体待测样品每孔100微升,冰上孵育2小时。用facs缓冲液离心洗涤2次,加入每孔100微升荧光(alexa488)标记的二抗(购自invitrogen),冰上孵育1小时。用facs缓冲液离心洗涤3次,加入每孔100微升固定液[4%(v/v)多聚甲醛]悬浮细胞,10分钟后用facs缓冲液离心洗涤2次。用100微升facs缓冲液悬浮细胞,用facs(facscalibur,购自bd公司)检测和分析结果。结果如图7~8和表10~11所示,表10~11说明,待测抗体可结合细胞表面的pd-l1蛋白。其中igg对照为人igg,表中的数据为mfi所测细胞群的平均荧光强度值。表10facs检测pd-l1抗体与chok1-hpd-l1的结合反应表11facs检测pd-l1抗体与chok1-cpd-l1的结合反应c、抗pd-l1抗体亲和力的分析测定使用octetred96仪器(购自fortiebio)进行亲和常数的测定。具体操作和方法根仪器说明书和厂家提供的详细方法。用链霉素亲和素传感器(sasensor,购自fortiebio)进行亲和力测定。将生物素标记的人pd-l1-hfc(即免疫原a)用含0.1%(w/w)bsa和0.02%(w/w)tween、ph7.4的pbs稀释至10μg/ml,然后与链霉素亲和素传感器反应。结合pd-l1-hfc的传感器与五个不同浓度梯度稀释的pd-l1抗体在30℃下温育三分钟,再和含0.1%(w/v)bsa和0.02%(w/v)tween、ph7.4的pbs溶液30℃下温育5分钟。通过octet仪器检测干涉波长的变化来检测抗体与免疫原a结合与解离。然后用usersoftware软件拟合得到解离常数与结合常数,亲和力常数为解离常数与结合常数的比值。表12pd-l1抗体对人pd-l1的亲和常数实施例4检测pd-l1抗体阻断pd-l1蛋白与其受体pd-1或b7.1的结合pd-l1蛋白的受体配体结合试验检测pd-l1抗体阻断pd-l1蛋白与其受体pd-1或b7.1的结合。将实施例1中纯化的pd-l1胞外区蛋白(pd-l1-hfc)用pbs稀释到终浓度1.0μg/ml,然后以100μl每孔加到96孔elisa板。用塑料膜封好4℃孵育过夜,第二天用洗板液[含0.01%(v/v)tween20的pbs]洗板2次,加入封闭液[含0.01%(v/v)tween20和1%(w/w)bsa的pbs]室温封闭2小时。倒掉封闭液,先加入实施例2所得的纯化的pd-l1抗体待测样品50μl每孔,后加入生物素标记的pd-1胞外区蛋白(pd-1-hfc)或b7.1-hfc,每孔100微升,混匀后37℃孵育。2小时后,用洗板液[含0.01%(v/v)tween20的pbs]洗板3次。加入hrp(辣根过氧化物酶)标记的亲和素稀释液(购自sigma)每孔100微升,37℃孵育2小时后,用洗板液[含0.01%(v/v)tween20的pbs]洗板3次。加入tmb底物100μl每孔,室温孵育30分钟后,加入终止液(1.0nhcl)100μl每孔。用elisa读板机(spectramax384plus,moleculardevice)读取a450nm数值,结果如图9~10和表13~14所示,图9~10和表13~14说明,所得抗体可不同程度的抑制pd-l1蛋白与其受体pd-1或b7.1的结合。其中igg对照为人igg,表中的数据为抑制率(%)。表13pd-l1抗体对pd-l1蛋白与其受体pd-1的结合的抑制表14pd-l1抗体对pd-l1蛋白与其受体b7.1的结合的抑制pd-1-hfc和b7.1-hfc的制备方法与实施1步骤(一)中所述生物素标记的pd-l1-hfc的制备方法相同,其中pd-1蛋白胞外区(leu25-glu167)氨基酸序列参见uniprot数据库,编号q15116。b7.1蛋白胞外区(val35-asn242)氨基酸序列参见ncbi数据库,编号为np_005182。生物素化试剂购自sigma,并按产品说明书进行生物素化标记蛋白。实施例5淋巴细胞刺激实验检测pd-l1抗体对淋巴细胞活性的影响淋巴细胞刺激实验检测pd-l1抗体阻断pd-l1蛋白与其受体pd-1和b7.1的结合从而解除其对t淋巴细胞活性的抑制,从而刺激t细胞的增殖。(一)ficoll分离全血获取外周血单核淋巴细胞pbmc。将新鲜获取的全血用磷酸缓冲液pbs以1:1的体积比例稀释得稀释后的全血,用无菌吸管轻轻将稀释后的全血铺平在ficoll液面(购自gehealthcare),ficoll与稀释后的全血的体积比为3:4,避免震荡混匀,以400g转速室温20℃梯度离心30分钟,离心后的离心管分为三层,上层为血浆,中间乳白色分层即为单核淋巴细胞。用无菌吸管轻轻吸取中间层细胞,收集至新的离心管,用pbs磷酸缓冲液稀释至三倍体积,100g转速室温离心10分钟,弃上清。将淋巴细胞用pbs磷酸缓冲液重悬至10ml,重复前面步骤取出血小板。最后将淋巴细胞重悬至10ml含有10%胎牛血清的多组份rpmi1640培养基(购自invitrogen)备用,即为外周血单核淋巴细胞pbmc,所述百分比为质量百分比。(二)pbmc刺激实验为构建pd-l1和anti-cd3单链抗体在细胞膜上共表达的chok1或293f的稳定细胞株,构建了含编码pd-l1全长蛋白的核苷酸序列的质粒pires-puro-pd-l1。为使anti-cd3(okt3)(参见kipriyanovetal.1997,peds10:445-453)嵌合的scfv能锚定在细胞膜上,将该scfv与mousecd8a(ncbiaccessionno:np—001074579.1)的c端113-220氨基酸序列连接,构建成质粒pires-os8。质粒pires-puro-pd-l1和质粒pires-os8的制备方法参见joesambrook,molecularcloning:alaboratorymanual。将上述质粒pires-puro-pd-l1和质粒pires-os8共同转染chok1和293f细胞,按实施例1中所述的质粒转染细胞的方法制备稳定传代细胞株chok1-pd-l1/os8和稳定传代细胞株293f-pd-l1/os8,并将两者作为t淋巴细胞刺激因子。使用前,将t淋巴细胞刺激因子chok1-pd-l1/os8和293f-pd-l1/os8用10μg/ml丝裂霉素,37℃处理3小时。同时配制等体积比稀释的待测实施例2所得的纯化的pd-l1抗体,得待测样品溶液。将实施例5步骤(一)获得的外周血单核淋巴细胞pbmc以5╳104个细胞100微升每孔铺至96孔细胞培养板,然后将所述的待测样品溶液加入培养板,室温培养15分钟。最后加入t淋巴细胞刺激因子chok1-pd-l1/os8或293f-pd-l1/os8,每反应孔中含有50微升5╳103个t淋巴细胞刺激因子,保证每个反应孔200μl体积,将反应板于37℃、5%co2培养箱培养72小时后收集上清,得细胞上清液,于-20℃冻存,所述百分比为体积百分比。(三)细胞上清中细胞因子伽马干扰素(ifn-γ)或白介素il-2酶联免疫吸附检测。细胞上清中细胞因子伽马干扰素(ifn-γ)或白介素il-2酶联免疫吸附检测使用r&dsystem相关检测试剂盒humanifn-gammaquantikin(dif50)和quantikineelisahumanil-2(s2050),并按照说明书操作。除检测抗体外的所有检测试剂均由检测试剂盒提供。测定细胞上清中细胞因子伽马干扰素(ifn-γ)或白介素il-2含量的酶联免疫吸附检测采用双抗夹心elisa试剂盒(购自r&dsystems,ifn-γcat#dif50和il-2cat#s2050)。实验操作严格按照试剂盒说明书要求,所有检测试剂均由试剂盒提供。具体实验简述如下:将ifn-γ或il-2多克隆抗体包被于elisa微孔板上,将实施例5步骤(二)获得的细胞上清液作为待测样品,加入标准品和待测样品室温孵育2小时。每孔加入400微升洗液,重复洗板4次;再加入抗人ifn-γ或il-2的辣根过氧化物酶标抗体,室温孵育2小时,与微孔板上的ifn-γ或il-2形成免疫复合物,清洗微孔;加入底物显色,避光室温30分钟,最终加入终止液,用酶标仪测定a450nm吸光度。检测pd-l1抗体在实施例5步骤(二)所述pbmc刺激实验中对ifn-γ分泌的影响。结果如图11,和表15所示,表15说明,在pbmc淋巴细胞刺激试验中待测抗体可使pbmc的ifn-γ分泌增强。其中higg对照为人igg,表中的数据为ifn-g值(pg/ml)。表15pd-l1抗体在pbmc淋巴细胞刺激试验中对ifn-γ分泌的影响实施例6混合淋巴细胞实验检测pd-l1抗体阻断pd-1或b7.1与pd-l1结合后对t淋巴细胞的抑制(一)人cd14+树突前体细胞的分离培养从全血中用使用试剂ficollpaqueplus(购自gehealthecare)并按照其说明书操作分离pbmc细胞。具体步骤也如实施例5中步骤(一)所述。收集pbmc细胞后进行细胞计数,以1╳105个细胞每毫升接种至含有10%胎牛血清的rpmi1640完全培养基的t75培养瓶中,所述百分比为质量百分比。将细胞置于37℃,5%(v/v)co2培养箱中孵育2小时,所述百分比为体积百分比,倾出未贴壁细胞上清,置入新的t75培养瓶,向已倾出上清的培养瓶中补充含有10%(w/w)胎牛血清的rpmi1640完全培养基,于37℃,5%(v/v)co2培养箱继续孵育2小时。倾出所有培养瓶里未贴壁细胞上清,含有10%(w/w)胎牛血清的rpmi1640完全培养基,于37℃,5%(v/v)co2培养箱继续孵育18小时。倾出所有培养瓶里未贴壁细胞上清,补充含有500u每毫升重组人源gm-csf(购自peprotech)和500u每毫升重组人源白介素il-4(购自peprotech)的带血清完全培养基,于37℃,5%(v/v)co2培养箱中培养4天并换液补充gm-csf和il-4,继续培养2天。将培养液置换为含有1μg/ml脂多糖lps的完全培养基rpmi1640培养18小时。用含有edta的pbs磷酸缓冲液收集树突细胞,300g离心5分钟去除edta,重复离心清洗细胞,即得人cd14+树突前体细胞(pbmc细胞)。重悬至培养基计数备用。(二)人cd4+细胞的分离纯化使用人cd4+细胞提取试剂盒对步骤(一)所得的pbmc细胞(r&dsystems,magcellecttmhumancd4+tcellisolationkit)按说明书进行操作,得分离纯化的cd4+细胞(三)混合淋巴细胞实验。将步骤(二)所得的分离纯化的cd4+细胞和步骤(一)来自于不同健康的志愿者的树突细胞共同接种至96孔细胞培养板,接种密度分别为每孔1╳105和2╳104,以80微升1╳105个细胞数量每孔铺至96细胞培养板。然后加入实施例2所得的纯化的pd-l1抗体待测样品于对应孔,于37℃,5%co2培养箱孵育6天。收集细胞上清,用于细胞因子检测,所述百分比为体积百分比。(四)细胞上清中细胞因子伽马干扰素(ifn-γ)或白介素il-2酶联免疫吸附检测。将步骤(三)所得的细胞上清中细胞因子伽马干扰素(ifn-γ)或白介素il-2进行酶联免疫吸附检测。使用r&dsystem相关检测试剂盒humanifn-gammaquantikin(dif50)和quantikineelisahumanil-2(s2050),并按照说明书操作。除检测抗体外的所有检测试剂均由检测试剂盒提供。检测pd-l1抗体在混合淋巴细胞试验中对il-2分泌的影响。结果如图12~13和表16~17所示,表16~17说明,混合淋巴细胞实验中,il2水平随着加入待测抗体浓度的增加而增加。其中igg对照为人igg,表中的数据为il-2值(pg/ml)。表16pd-l1抗体在混合淋巴细胞试验中对il-2分泌的影响表17pd-l1抗体在混合淋巴细胞试验中对il-2分泌的影响检测pd-l1抗体在混合淋巴细胞试验中对ifn-γ分泌的影响。结果如图14~15、图16~17、表18~19和表20~21所示,表18~19和表20~21说明,混合淋巴细胞实验中,ifn-γ水平随着加入待测抗体浓度的增加而增加。其中higg和igg对照为人igg,表中的数据为ifn-g值(pg/ml)。表18pd-l1抗体在混合淋巴细胞试验中对ifn-γ分泌的影响表19pd-l1抗体在混合淋巴细胞试验中对ifn-γ分泌的影响表20pd-l1抗体在混合淋巴细胞试验中对ifn-γ分泌的影响表21pd-l1抗体在混合淋巴细胞试验中对ifn-γ分泌的影响检测pd-l1抗体在混合淋巴细胞试验中对il-2分泌的影响。结果如图18~19和表22~23所示,表22~23说明,混合淋巴细胞实验中,il2水平随着加入待测抗体浓度的增加而增加。其中igg对照为人igg,表中的数据为il-2值(pg/ml)。表22pd-l1抗体在混合淋巴细胞试验中对il-2分泌的影响表23pd-l1抗体在混合淋巴细胞试验中对il-2分泌的影响检测pd-l1抗体在混合淋巴细胞试验中对ifn-γ分泌的影响,结果如图20~21和表24~25所示。表24~25说明,在混合淋巴细胞实验中,ifn-γ水平随着加入待测抗体浓度的增加而增加。其中igg对照为人igg,表中的数据为ifn-g值(pg/ml)。表24pd-l1抗体在混合淋巴细胞试验中对ifn-γ分泌的影响表25pd-l1抗体在混合淋巴细胞试验中对ifn-γ分泌的影响其中,表16、表18、表20、表22和表24的数据与表17、表19、表21、表23和表25的数据所反映的是分别使用不同的pbmc细胞作为供体,进行两次独立的重复试验的结果。实施例7轻重链可变区氨基酸序列测定总rna分离:将实施例1亚克隆培养所得的上清液检验过抗原结合后(即经过实施例3~6的检定和活性测定后),通过离心搜集5×107个杂交瘤细胞,加入1mltrizol混匀并转移到1.5ml离心管中,室温静置5分钟。加0.2ml氯仿,振荡15秒,静置2分钟后于4℃,12000g离心5分钟,取上清转移到新的1.5ml离心管中。加入0.5ml异丙醇,将管中液体轻轻混匀,室温静置10分钟后于4℃,12000g离心15分钟,弃上清。加入1ml75%乙醇(所述百分比为体积百分比),轻轻洗涤沉淀,4℃,12000g离心5分钟后弃上清,将沉淀物晾干,加入depc处理过的h2o溶解(55℃水浴促溶10分钟),即得总rna。逆转录与pcr:取1μg总rna,配置20μl体系,加入逆转录酶后于42℃反应60分钟,于7℃反应10分钟终止反应。配置50μlpcr体系,包括1μlcdna、每种引物25pmol、1μldna聚合酶以及相配的缓冲体系、250μmoldntps。设置pcr程序,预变性95℃3分钟,变性95℃30秒,退火55℃30秒,延伸72℃35秒,35个循环后再额外于72℃延伸5分钟,得pcr产物。其中逆转录所用的试剂盒为primescriptrtmastermix,购自takara,货号rr036;pcr所用的试剂盒为q5超保真酶,购自neb,货号m0492。克隆与测序:取5μlpcr产物进行琼脂糖凝胶电泳检测,将检测阳性样品使用柱回收试剂盒纯化,其中回收试剂盒为gel&pcrclean-up,购自macherey-nagel,货号740609。进行连接反应:样品50ng,t载体50ng,连接酶0.5μl,缓冲液1μl,反应体系10μl,于16℃反应半小时得连接产物,其中连接的试剂盒为t4dna连接酶,购自neb,货号m0402;取5μl连接产物加入100μl的感受态细胞(ecos101competentcells,购自yeastern,货号fye607)中,冰浴5分钟。而后于42℃水浴热激1分钟,放回冰上1分钟后加入650μl无抗生素soc培养基,于37℃摇床上以200rpm的速度复苏30分钟,取出200μl涂布于含抗生素的lb固体培养基上于37℃孵箱过夜培养。次日,使用t载体上引物m13f和m13r配置30μlpcr体系,进行菌落pcr,用移液器枪头蘸取菌落于pcr反应体系中吹吸,并吸出0.5μl点于另一块含100nm氨苄青霉素的lb固体培养皿上以保存菌株。pcr反应结束后,取出5μl进行琼脂糖凝胶电泳检测,将阳性样品进行测序。其中,测序的步骤参见kabat,sequencesofproteinsofimmunologicalinterest,nationalinstitutesofhealth,bethesda,md.(1991)。测序结果如表26~27所示:表26pd-l1抗体蛋白序列编号其中,表26中的数字即为序列表“seqidno.”编号,如78b2d7的重链蛋白可变区的氨基酸序列为序列表seqidno.1,而78b2d7的重链蛋白可变区中cdr1域的氨基酸序列为序列表seqidno.2。表27pd-l1抗体基因序列编号其中,表27中的数字即为序列表“seqidno.”编号,如编码78b2d7的重链蛋白可变区的核苷酸序列为序列表seqidno.33。其中,编码78b2d7的重链蛋白可变区中cdr1域的核苷酸序列为序列表seqidno.33中的第76位至第105位;编码78b2d7的重链蛋白可变区中cdr2域的核苷酸序列为序列表seqidno.33中的第148位至第198位;编码78b2d7的重链蛋白可变区中cdr3域的核苷酸序列为序列表seqidno.33中的第295位至第327位;编码78b2d7的轻链蛋白可变区中cdr1域的核苷酸序列为序列表seqidno.37中的第70位至第102位;编码78b2d7的轻链蛋白可变区中cdr2域的核苷酸序列为序列表seqidno.37中的第148位至第168位;编码78b2d7的轻链蛋白可变区中cdr3域的核苷酸序列为序列表seqidno.37中的第265位至第291位;编码78a11f6的重链蛋白可变区中cdr1域的核苷酸序列为序列表seqidno.34中的第76位至第105位;编码78a11f6的重链蛋白可变区中cdr2域的核苷酸序列为序列表seqidno.34中的第148位至第198位;编码78a11f6的重链蛋白可变区中cdr3域的核苷酸序列为序列表seqidno.34中的第295位至第330位;编码78a11f6的轻链蛋白可变区中cdr1域的核苷酸序列为序列表seqidno.38中的第70位至第102位;编码78a11f6的轻链蛋白可变区中cdr2域的核苷酸序列为序列表seqidno.38中的第148位至第168位;编码78a11f6的轻链蛋白可变区中cdr3域的核苷酸序列为序列表seqidno.38中的第265位至第291位;编码105c5d7的重链蛋白可变区中cdr1域的核苷酸序列为序列表seqidno.35中的第76位至第105位;编码105c5d7的重链蛋白可变区中cdr2域的核苷酸序列为序列表seqidno.35中的第148位至第198位;编码105c5d7的重链蛋白可变区中cdr3域的核苷酸序列为序列表seqidno.35中的第295位至第324位;编码105c5d7的轻链蛋白可变区中cdr1域的核苷酸序列为序列表seqidno.39中的第70位至第102位;编码105c5d7的轻链蛋白可变区中cdr2域的核苷酸序列为序列表seqidno.39中的第148.位至第168位;编码105c5d7的轻链蛋白可变区中cdr3域的核苷酸序列为序列表seqidno.39中的第265位至第291位;编码73d3g2的重链蛋白可变区中cdr1域的核苷酸序列为序列表seqidno.36中的第76位至第105位;编码73d3g2的重链蛋白可变区中cdr2域的核苷酸序列为序列表seqidno.36中的第148位至第198位;编码73d3g2的重链蛋白可变区中cdr3域的核苷酸序列为序列表seqidno.36中的第295位至第330位;编码73d3g2的轻链蛋白可变区中cdr1域的核苷酸序列为序列表seqidno.40中的第70位至第102位;编码73d3g2的轻链蛋白可变区中cdr2域的核苷酸序列为序列表seqidno.40中的第148位至第168位;编码73d3g2的轻链蛋白可变区中cdr3域的核苷酸序列为序列表seqidno.40中的第265位至第288位。实施例8全人抗体igg转化和制备(1)质粒构建与准备:实施例2已从杂交瘤细胞的培养上清液中获得了纯化的pd-l1抗体,并根据实施例7的测序结果明确了pd-l1抗体的重链可变区和轻链可变区序列。将pd-l1抗体的重链可变区序列重组到包含信号肽和人源重链抗体igg1恒定区的表达载体(其中表达载体购买自invitrogen,重组步骤也由上海睿智化学完成)中,将pd-l1抗体的轻链可变区序列重组到包含信号肽和人源抗体轻链kappa恒定区的表达载体当中,得重组质粒并经测序验证(测序方法与实施例7中测序方法相同)。使用碱裂解法试剂盒(购自macherey-nagel)中量抽提高纯度的重组质粒,质量为500μg以上,经0.22μm滤膜(购自millopore)过滤,供转染使用。(2)细胞转染:在培养基freestyle293expressionmedium(购自invitrogen)培养293e细胞(购自invitrogen)。摇床设置为37℃、130rpm,8%co2(v/v)浓度。freestyle293expressionmedium在转染时添加10%(v/v)f68(购自invitrogen)至f68终浓度为0.1%(v/v),得含0.1%(v/v)f68的freestyle293表达培养基,即培养基a。取5ml培养基a和200μg/mlpei(购自sigma)混匀,得培养基b。取5ml培养基a和100μg/ml步骤(1)所得的重组质粒混匀,得培养基c。5分钟后将培养基b和培养基c合并混匀,静置15分钟,得混合液d。将10ml混合液d缓缓加入100ml含293e细胞的培养基freestyle293expressionmedium中至293e的细胞密度为1.5×106/ml,边加边振荡,避免pei过度集中,放入摇床培养。第二天加入蛋白胨至终浓度为0.5%(w/v)。第5~7天,测培养液抗体效价。第6~7天,离心(3500rpm,30分钟)收集上清,经0.22μm滤膜过滤,得滤好的细胞上清液,以供纯化。(3)抗体纯化:对于连续生产的无内毒素的层析柱和proteina填料(购自ge),使用0.1mnaoh处理30分钟或者5个柱体积的0.5mnaoh冲洗。对于长期未使用的柱料和层析柱至少使用1mnaoh浸泡1h,用无内毒的水冲洗至中性,用10倍柱体积的1%(v/v)triton×100对柱料清洗。使用5个柱体积的pbs(pbs磷酸缓冲液,ph7.2)进行平衡,将步骤(2)所得过滤好的细胞上清液上柱,必要时收集流穿液。上柱完成后,使用5倍柱体积的pbs清洗。用5倍柱体积的0.1mph3.0的glycine-hcl进行洗脱,收集洗脱液,并用0.5倍柱体积洗脱液的ph8.5的1mtris-hcl(1.5mnacl)中和,收获全人pd-l1抗体。上述所用溶液均需要新配置。收获全人pd-l1抗体后,在1╳pbs中透析4小时,避免内毒素污染。透析结束后,使用分光光度或试剂盒测定浓度,使用hplc-sec测定抗体纯度,使用内毒素检测试剂盒(购自lonza)检测抗体内毒素含量。并对所获全人pd-l1抗体进行特性鉴定(同实施例4,实施例6),检测结果分别如图22~27和表28~33所示。图22~23和表28~29说明,经过全人igg转化并制备所得全人pd-l1抗体能够阻断pd-l1与pd-1和b7.1的结合。表28全人pd-l1抗体对pd-l1蛋白与其受体pd-1的结合的抑制表29全人pd-l1抗体对pd-l1蛋白与其受体b7.1的结合的抑制表30~31和图24~25说明,全人源化抗体在混合淋巴细胞试验中能够刺激il-2分泌。表32~33和图26~27说明,全人源化抗体在混合淋巴细胞试验中能够刺激ifn-γ分泌。其中igg对照为人igg(higg),表中的数据为od450nm值。表30pd-l1全人源抗体在混合淋巴细胞试验中对il-2分泌的影响表31pd-l1全人源抗体在混合淋巴细胞试验中对il-2分泌的影响表32pd-l1全人源抗体在混合淋巴细胞试验中对ifn-γ分泌的影响表33pd-l1全人源抗体在混合淋巴细胞试验中对ifn-γ分泌的影响其中,表32和表33分别反映了使用不同的pbmc细胞作为供体,进行两次独立的重复试验的结果。应理解,在阅读了本发明的上述内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1