一种抑制淀粉样β蛋白聚集的双功能短肽抑制剂及其应用的制作方法
本发明涉及一种双功能短肽抑制剂(Ac-LVFFARKHH-NH2)及其对Cu2+介导的淀粉样β蛋白的聚集、氧化自由基粒子产生率和细胞毒性的有效抑制作用,以及其潜在的药物和保健品开发方面的用途。
背景技术:
阿尔兹海默症(Alzheimer’s Disease,AD)是一种淀粉样变病,该病症起病隐匿,在进行性发展中造成神经系统的退行性病变,是老年痴呆症最主要的发病形式。AD发病的主要原因之一是淀粉样β蛋白(amyloidβ-protein,Aβ)的大量产生和聚集形成纤维,在这个过程中富集吸附多种金属离子,最终形成老年斑(senile plaque,SP),对神经元细胞产生较高的毒害作用。
Aβ是淀粉样前体蛋白(amyloid-βprecursor protein,APP)经由β和γ分泌酶切割而形成的含有39-43个氨基酸残基的多肽。Aβ的两种主要类型为Aβ40和Aβ42,其中Aβ40含量最为丰富。研究表明Aβ单体在水溶液条件下呈现无规则卷曲结构,在聚集形成纤维的过程中首先通过构象转变形成富含β-折叠的二级结构,然后通过分子间疏水相互作用、氢键、盐键等作用力聚集在一起逐渐形成成熟纤维。在聚集过程中形成的可溶性Aβ寡聚体和原纤维是最具神经毒性的。同时,Aβ还具有络合金属离子的能力,在AD患者大脑组织中的老年斑内发现Cu2+、Zn2+、Fe3+、Al3+发生富集,老年斑周围的脑组织中多种金属离子浓度升高。其中Aβ-Cu2+络合体由于能够促进Aβ聚集和催化产生氧化自由基粒子(radical oxygen species,ROS),因此会造成神经元细胞氧化压力的增大,导致细胞死亡。
针对Aβ聚集产生有毒聚集体,研究者开发了诸多能够有效抑制Aβ聚集的抑制剂,如:姜黄素、EGCG、多肽、抗体等以及纳米粒子抑制剂。由于Aβ的疏水核心序列对于Aβ的聚集具有重要作用,因此研究者基于此多肽设计开发了一系列具有明显抑制Aβ聚集效果的多肽抑制剂。但研究表明在体内,Aβ聚集过程中常会伴随金属离子的络合,因此近些年来许多研究者致力于开发双功能的Aβ聚集抑制分子,使其既能够螯合金属离子,又能抑制Aβ聚集。本发明是在先前Aβ聚集抑制短肽LVFFARK的基础上,通过在其C末端添加能够络合Cu2+的螯合片段HH设计成的双功能短肽抑制剂,可以实现抑制Aβ聚集和鳌合金属离子双功能,为开发新型药物提供新的设计思路。
技术实现要素:
本发明的目的是开发抑制Aβ聚集毒性的新型抑制剂,提出设计合成一种既能够抑制Aβ40蛋白聚集,降低Aβ40蛋白造成的神经细胞毒性,又能降低Aβ-Cu2+络合体催化产生ROS速率的一种新的双功能短肽抑制剂(Ac-LKFFARKHH-NH2),以及其抑制淀粉样β蛋白聚集和相关细胞毒性方面的应用。
本发明的技术方案如下:
一种抑制淀粉样β蛋白聚集的双功能短肽抑制剂;其氨基酸序列为:Leu-Val-Phe-Phe-Ala-Arg-Lys-His-His。
本发明的抑制淀粉样β蛋白聚集的双功能短肽抑制剂抑制Cu2+存在下β-淀粉样蛋白聚集及其相关细胞毒性的应用。
应用为双功能短肽与β-淀粉样蛋白摩尔浓度比优选为1:1。
抑制淀粉样β蛋白聚集的双功能短肽抑制剂用于阿尔兹海默症药物和保健品开发方面的用途。
抑制淀粉样β蛋白聚集的双功能短肽抑制剂用于用于阿尔兹海默症的药物的原料药。
本发明设计合成的双功能短肽抑制剂是基于Aβ的疏水核心序列(KLVFFAE)得到的一个九肽,本身具有抑制Aβ聚集的能力;端基乙酰化和酰胺化之后,具有降低多肽在血浆中的代谢速度和增强穿透血脑屏障的能力;带正电荷HH的引入,增大了多肽间的排斥力,不利于多肽自身的聚集,同时可以螯合Cu2+,降低由Aβ-Cu2+络合体催化产生的ROS对细胞的影响。因此使之成为具有前景的治疗AD的候选药物。
本发明的优点:
多种实验手段证明,双功能短肽抑制剂与Aβ40蛋白摩尔浓度比在1:1时,就能够有效地抑制了Aβ40纤维的生成,并且抑制Aβ-Cu2+络合体催化产生ROS的速率,最终大幅降低了Aβ40的聚集和络合金属Cu2+所带来的细胞毒性作用,是Aβ40聚集和神经细胞氧化压力的有效抑制剂。
附图说明
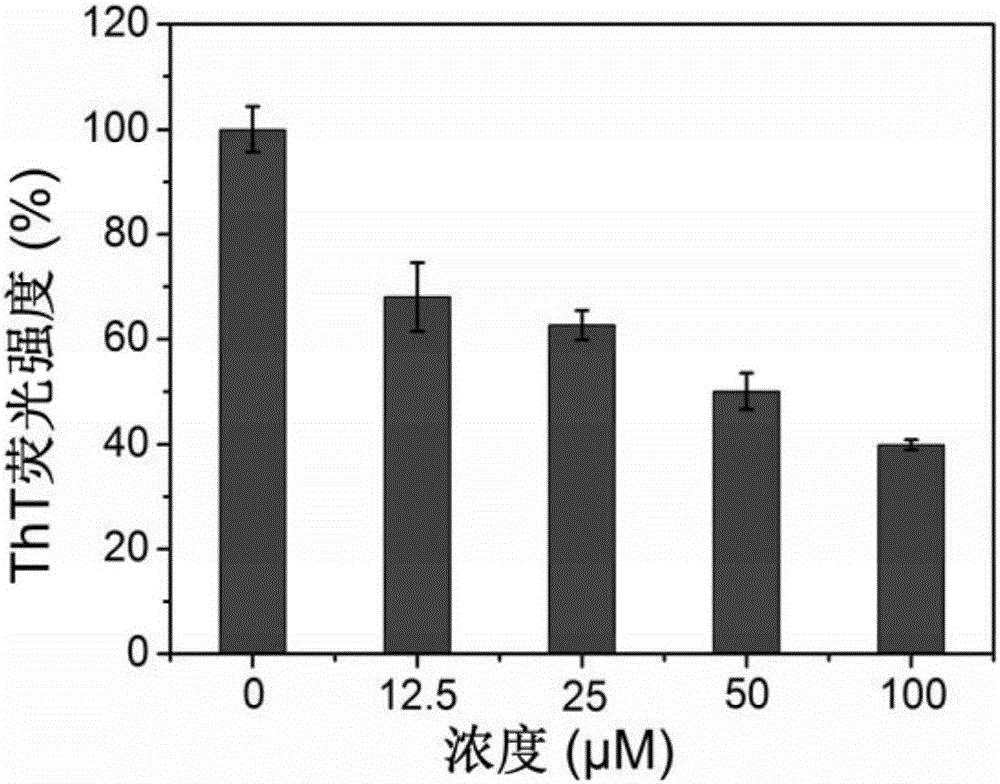
图1:不同浓度的双功能短肽抑制剂与Aβ40共培养72h后的ThT荧光强度变化;
图2:摩尔浓度比为1:0.4:1的Aβ40、Cu2+和双功能短肽抑制剂共培养的ThT荧光动力学;
图3:摩尔浓度比为1:0.4:1的Aβ40、Cu2+和双功能短肽抑制剂共培养的培养物形貌(图3C),其中图3A为单独培养Aβ40形成的聚集体的形貌,图3B为摩尔浓度比为1:0.4的Aβ40和Cu2+共同培养形成的聚集体的形貌。
图4:双功能短肽抑制剂对Aβ-Cu2+络合体催化产生·OH生成速率的影响;
图5:Aβ40与Cu2+和双功能短肽抑制剂按摩尔比1:0.4:1共培养24h后培养物对PC-12细胞存活率的影响。
具体实施方式
下面结合具体实施例对本发明作进一步的说明。
我们通过多种物理化学生物的检测手段证实双功能短肽抑制剂可以有效抑制Aβ40聚集和抑制Aβ-Cu2+络合体催化产生ROS的速率,最终降低Aβ40的聚集和络合金属Cu2+所带来的细胞毒性作用。
双功能短肽抑制剂氨基酸序列:
Ac-Leu-Val-Phe-Phe-Ala-Arg-Lys-His-His-NH2
双功能短肽抑制剂结构式:
实施例1:不同浓度双功能短肽抑制剂与Aβ40共培养72h后的ThT荧光强度变化
首先将储存于-80℃冰箱的Aβ40置于室温下,待其温度升至室温,称取Aβ40粉末以1mg/mL的浓度溶于纯六氟异丙醇;将此溶液在-4℃下静置2h,待其完全溶解后超声2min以打散Aβ40聚集体;将超声后的Aβ40溶液于4℃,16000g离心20min,取上清的75%;将取出的75%上清液在-80℃冰箱内冻实4h以上,随后冷冻干燥24h,得到预处理好的蓬松棉絮状的Aβ40,置于-20℃下保存。
溶液配制如下:称取2.2mg Aβ40溶于2mL 20mM NaOH溶液中,配制成终浓度为250μM的Aβ母液,冰浴超声处理20min,使其完全溶解;称取8mg的ThT溶于1L HEPES缓冲液(20mM HEPES,NaCl 100mM,pH=7.4)中,使其浓度为25μM;称取0.47mg的双功能短肽抑制剂溶于200mL DMSO中,使其浓度为2mM。
利用HEPES缓冲液进行稀释,使各实验组均含有Aβ40 25μM,双功能短肽抑制剂的浓度分别为0μM、12.5μM、25μM、50μM和100μM。用漩涡混合器混合均匀,将在37℃,150rpm条件下震荡共培养72h。检测时用ThT染液将培养液稀释20倍后,测定ThT荧光强度。以仅含Aβ的样品为100%,无Aβ与抑制剂的缓冲液为0进行归一化,绘制ThT荧光强度百分比随时间的变化曲线,每个实验点取三次重复实验的平均值。荧光光度计仪器参数:激发波长440nm(激发带宽5nm);发射波长480nm(发射带宽5nm)。结果如图1所示。
由图1可知,加入双功能短肽抑制剂双功能短肽抑制剂后Aβ40的ThT荧光强度明显下降,说明双功能短肽抑制剂能有效抑制Aβ40的聚集。ThT荧光强度下降程度与双功能短肽抑制剂的浓度呈正比,说明双功能短肽抑制剂浓度越高,其抑制Aβ40聚集效果越好。
实施例2:摩尔浓度比为1:0.4:1的Aβ40、Cu2+和双功能短肽抑制剂共培养的ThT荧光动力学
按照与实施例1相同的方法处理Aβ40单体和双功能短肽抑制剂;另称取CuCl2·2H2O85.25mg溶于去离子水中,配制成10mL 20mM的Cu2+母液,然后用去离子水稀释成0.5mM的溶液待用;称取ThT 2mg溶于25mL HEPES缓冲液中,配制成250μM的ThT母液待用。
配制ThT、Aβ40和双功能短肽抑制剂的终浓度均为25μM,Cu2+浓度为10μM,混合均匀。将样品加入96孔板中,每孔点加样品200μL,培养检测。酶标仪设置参数:温度37℃,摇动持续时间5s,波幅3mm,频率452.1rpm;激发波长440nm(激发带宽9nm);发射波长480nm(发射带宽20nm);手动增益值90。实验结果如图2所示。
由图2可知,Cu2+具有促进Aβ40聚集的作用,可以显著缩短Aβ40的延滞期。在含有Cu2+的Aβ40培养体系中加入双功能短肽抑制剂后,Aβ40的延滞期有一定的增大,并且ThT荧光强度显著的下降,说明双功能短肽抑制剂能够络合Cu2+,并且具有抑制Cu2+介导的Aβ40的快速聚集作用。
实施例3:摩尔浓度比为1:0.4:1的Aβ40、Cu2+和双功能短肽抑制剂共培养的培养物形貌(图3C),其中图3A为单独培养Aβ40形成的聚集体的形貌,图3B为摩尔浓度比为1:0.4的Aβ40和Cu2+共同培养形成的聚集体的形貌。
按照与实施例1、2相同的方法处理Aβ40单体Cu2+和双功能短肽抑制剂,并按照相同的方法进行培养72h。
培养到72h后,取100μL培养液,超声10min,将5-10μL溶液滴加在300目的碳膜铜网上,自然干燥。待铜网上的溶液将干未干时,滴加1%的磷钨酸溶液(pH 6.5)染色30s后吸掉多余液体,自然干燥。然后用透射电镜(JEM100CXII)进行观察,检测电压为100kV,选取放大后标尺为200nm的图像进行观察,结果如图3所示。
由图3可知,Aβ40在单独培养72h后形成了四五百纳米长的纤维聚集体(图3A);含有Cu2+的Aβ40培养后也能形成纤维,但其长度较Aβ40单独培养时要短(图3B);加入双功能短肽抑制剂双功能短肽抑制剂后,Aβ40形成了无规则蛋白聚集体(图3C)。这表明双功能短肽抑制剂的加入,改变了Aβ40纤维聚集形貌,能够抑制Aβ40纤维聚集体的形成。
实施例4:双功能短肽抑制剂对Aβ-Cu2+络合体催化产生·OH生成速率的影响按照与实施例1、2相同的方法处理Aβ40单体、双功能短肽抑制剂和Cu2+;另称取去铁胺0.33mg,加入到500mL HEPES缓冲液中得到含有1μM去铁胺的HEPES缓冲液;分别称取9.5mg 3-OH-CCA和9.9mg L-抗坏血酸,分别加入到10mL含有去铁胺的HEPES缓冲液中,配制成5mM的3-OH-CCA和L-抗坏血酸母液待用。
检测时按比例在石英皿中分别加入含有去铁胺的HEPES缓冲液、Cu2+、Aβ40、双功能短肽抑制剂和3-OH-CCA,最后加入L-抗坏血酸快速摇匀检测。体系中Aβ40、双功能短肽抑制剂的摩尔浓度均为25μM,Cu2+浓度为10μM,3-OH-CCA和L-抗坏血酸浓度为0.5mM。荧光激发波长390nm(激发带宽5nm),发射波长447nm(发射带宽5nm)。荧光强度的变化率表征·OH的产生速率。实验结果如图4所示。
由图4可知,Aβ-Cu2+络合体具有催化产生·OH的作用,而加入双功能短肽抑制剂双功能短肽抑制剂后·OH产生速率极大的降低,说明双功能短肽抑制剂可以络合体Cu2+,极大的抑制Aβ-Cu2+络合体催化产生·OH的能力。
实施例5:Aβ40与Cu2+和双功能短肽抑制剂按摩尔比1:0.4:1共培养24h后培养物对PC-12细胞存活率的影响
细胞毒性实验中使用的细胞为大鼠肾上腺髓质嗜铬瘤细胞(PC-12)。培养基为DMEM血清培养基(DMEM:FBS:penicillin=89:10:1,v/v/v)。培养环境为5%CO2,37℃恒温培养。按照与实施例1、2相同的方法处理Aβ40,双功能短肽抑制剂和Cu2+,实验组中双功能短肽抑制剂、Aβ40的终浓度为25μM,Cu2+浓度为10μM。
首先将处于对数期的PC-12细胞稀释成5000个/mL的密度,按每孔80μL的量加入96孔板中,每个实验组设置6个复孔作为平行组。培养24h后,加入20μL老化后的Aβ40溶液样品,使得孔中Aβ40:Cu2+:双功能短肽抑制剂为1:0.4:1,继续培养24h。然后在每孔中加入10μL MTT溶液(浓度为5.5mg/mL),继续培养4h。检测时,将96孔板以1500rpm的速度离心10min,离心后移除96孔板中溶液,每孔加入100μL的DMSO摇床震荡10min。待紫色晶体完全溶解后,使用酶标仪在570nm下测定吸光度,计算细胞存活率。以不含细胞的样品作为空白组(0%);不含Aβ40和抑制剂,仅含有细胞的样品作为对照组(100%),计算加药组的细胞存活率。***表示p>0.05。结果如图5所示。
由图5可知,Aβ40自聚集会产生细胞毒性,使细胞存活度降低到65%左右,而Aβ-Cu2+络合体毒性比单独培养Aβ4时要大,会使细胞存活度降低到50%左右,但是在Aβ-Cu2+络合体系中加入双功能短肽抑制剂后,可以显著提高细胞存活度至90%。该实验表明Aβ-Cu2+络合体的毒性不仅来自于Aβ40自聚集产生的毒性,还包括Aβ-Cu2+络合体催化产生的·OH给细胞带来的氧化性压力。双功能短肽抑制剂不仅可以抑制Aβ40的聚集,还可以络合Cu2+离子,降低·OH给细胞带来氧化性压力,极大的提高细胞的存活度。
本发明提出了双功能短肽抑制剂与Aβ40蛋白摩尔浓度比在1:1时能够有效抑制Aβ40蛋白的聚集并络合Cu2+离子,降低Aβ40聚集和Aβ-Cu2+络合体催化产生ROS相关的细胞毒性,具备潜在的药物和保健品开发方面的用途。已通过多项实施例对其抑制Aβ40和Aβ-Cu2+络合体的聚集、催化产生ROS和细胞毒性的效果进行了描述,相关技术人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法进行改动或适当变更与组合,来实现本发明技术。特别需要指出的是,所有相类似的替代和改动对本领域技术人员来说是显而易见的,他们都被视为包括在本发明精神、范围和内容中。
- 还没有人留言评论。精彩留言会获得点赞!