一种建立稳定转基因的牙鲆胚胎细胞株方法与流程
本发明属于海洋鱼类遗传学技术领域,具体涉及一种建立稳定转基因的牙鲆胚胎细胞株方法。
背景技术:
细胞转染指真核细胞由于外源DNA或RNA掺入而获得新遗传标志的过程。在研究基因功能、调控基因表达、突变分析和蛋白质生产等生物学试验中,其应用越来越广泛。迄今为止,多种外源基因转染细胞的方法已被开发。主要包括以病毒介导的外源基因转染细胞方法和非病毒介导的细胞转染方法。以上方法在植物和哺乳动物上已成功建立多种稳定遗传表达的细胞株。
然而,在牙鲆等海水鱼类中高效的细胞转染方法目前尚未见报道,在海水鱼细胞中建立稳定转基因的细胞株更是很少涉及,这已成为在细胞水平上分析和研究海水鱼类基因功能的主要瓶颈之一。因此,探究海水鱼类中高效的细胞转染方法,建立稳定遗传的海水鱼类细胞株,对于研究海水鱼类基因功能分析等至关重要。
技术实现要素:
本发明的目的在于提供一种建立稳定转基因的牙鲆胚胎细胞株方法,即利用脂质体和外源DNA质粒形成复合物进行转染细胞,再利用G418对转染后的细胞进行筛选,从而获得可稳定遗传的转基因细胞株。
1)转基因载体构建:
应用无启动子的pEGFP-1质粒体作为载体,在外源基因之前插入β-actin基因启动子构建成转基因质粒;
2)制备脂质体和外源DNA质粒复合物:
将阳离子脂质体溶液与目的转基因质粒溶液混合制成脂质体和外源DNA质粒复合物;
3)转染牙鲆胚胎细胞:
待牙鲆胚胎细胞汇合度达70%—80%时,把脂质体和外源DNA质粒复合物加入到细胞培养基中对牙鲆胚胎细胞进行转染;
4)G418筛选牙鲆阳性胚胎细胞:
转染24h后用一定浓度的G418对荧光检测呈阳性的牙鲆胚胎细胞进行筛选,之后更换为含有G418的DMEM/F12对阳性细胞进行富集;
所述的步骤2)中细胞转染中阳离子脂质体溶液与目的质粒溶液的体积比为22:1。
所述的步骤4)中600μg/m L的G418为筛选牙鲆胚胎细胞的最佳浓度;使用含有300μg/mL G418的DMEM/F12对阳性细胞进行富集。
本发明方法可将在牙鲆中广泛表达的β‐actin启动的外源基因有效转入牙鲆胚胎细胞,并且可以在牙鲆胚胎细胞中稳定遗传表达,为鲆鲽鱼类基因研究提供了一种新的方法,解决了因鲆鲽鱼类细胞瞬时转染效率低而难以进行细胞水平基因功能分析研究的问题,为鲆鲽鱼类分子水平遗传育种工作提供了新的技术手段,提供了用于使海水鱼类细胞系稳定遗传转基因方法。
附图说明
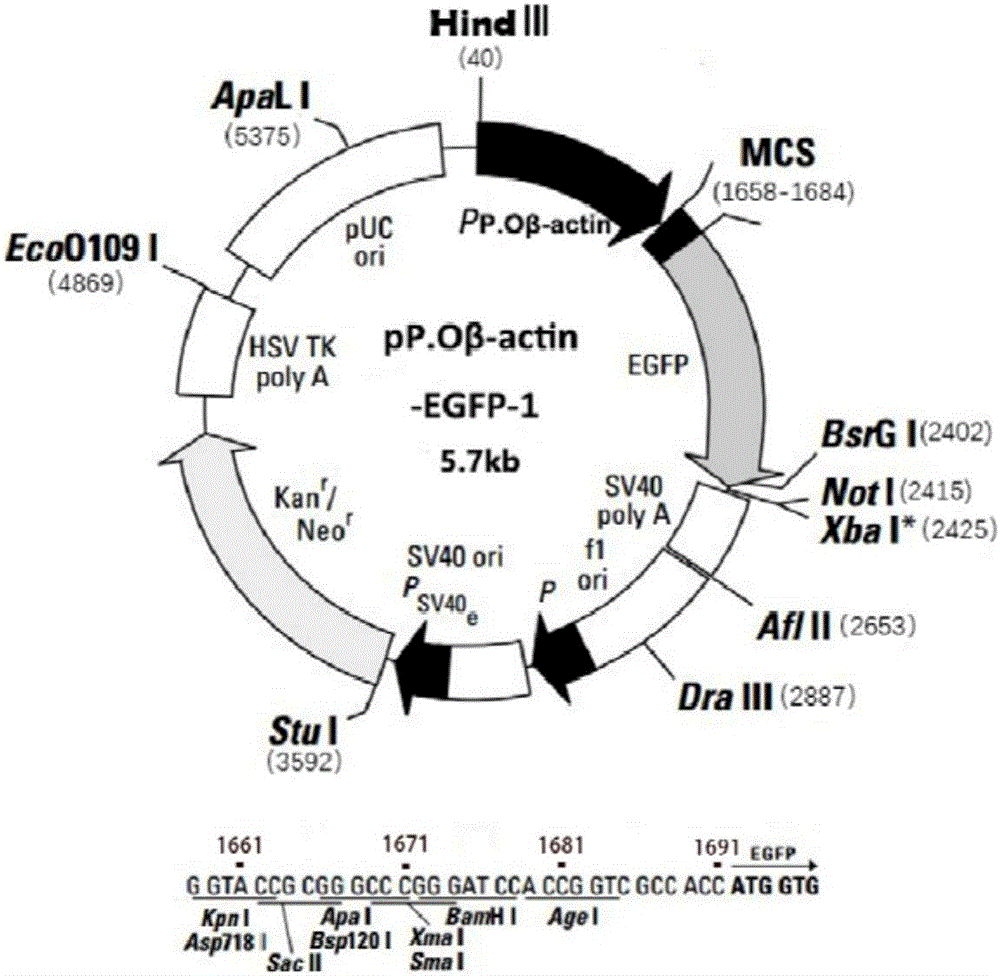
图1:本发明构建的质粒图谱,
图2:G418浓度的筛选图,其中A‐J分别为用含有0、100、200、300、400、500、600、700、800、900μg/mL G418的DMEM/F12处理两周的结果;
图3:转染24h后荧光结果图;
图4:G418筛选后荧光结果图;
图5:传代两个月稳定表达绿色荧光蛋白的牙鲆胚胎细胞图;
图6:DNA检测结果图。
具体实施方法
申请人在长期的研究中发现,使用核苷酸序列为SEQ ID NO:1的启动子,可以使外源基因在牙鲆鱼的胚胎细胞中高效表达;并对转染和筛选的方法进行了优化,最终获得了本发明。
1.外源质粒的构建
1)在绿色荧光蛋白(EGFP)之前插入牙鲆鱼的β-actin基因启动子(SEQ ID NO:1)构建成转基因质粒,在牙鲆β-actin启动子基因上设计一对两端带有限制性内切酶位点的PCR引物,其中5’和3’引物上加入了一个HindⅢ和KpnⅠ的酶切位点,进行PCR。其引物如下:
5’-primer:5’-CCCAAGCTTCGCGTCGTGCCCCAGTGT
3’-primer:3’-CGGGGTACCGGCTGAACTGCAGAGAGGAGAGA
PCR反应程序如下:95℃预变性5min,95℃变性30sec,68℃退火30sec,72℃延伸2min,循环40次,72℃后延伸10min。
2)利用胶回收试剂盒(TM16090646)回收扩增的P.Oβ-actin启动子片段,连接在pMD19-T载体上,利用氨苄抗性筛选带有目的片段的阳性菌。
3)利用限制性内切酶HindⅢ和KpnⅠ分别切开带有牙鲆β-actin启动子基因的质粒和带有EGFP绿色荧光的质粒,并使用胶回收试剂盒(TM16090646)回收切开的质粒片段;
4)使用T4连接酶将牙鲆β-actin启动子基因片段和带有EGFP绿色荧光的质粒链接起来,构建成转基因的外源DNA质粒(图1)。
2.确定G418筛选牙鲆胚胎细胞的最佳浓度
1)所用细胞为实验室培养的牙鲆胚胎细胞,已稳定传至135代。培养液为DMEM/F12。
2)在细胞汇合度达70%~80%时,用1m L 0.25%胰酶消化贴壁牙鲆胚胎细胞,在显微镜检测约70%细胞悬浮时,用等体积血清终止反应并收集细胞;然后按1∶2的比例进行传代培养,选取生长均一稳定的细胞进行转染、筛选实验。
3)取牙鲆胚胎细胞以1.0×105个/孔接种于12孔板,每3孔为1组,加入DMEM/F12培养24h后,分别更换含有0、100、200、300、400、500、600、700、800、900μg/m LG418的DMEM/F12,每隔3d换含有相同浓度G418的培养液1次。
4)连续在显微镜下检测两周,用G418筛选6d后细胞开始有大量死亡,两周左右全部死亡为筛选标准,选取达此标准的最小G418浓度为筛选牙鲆胚胎细胞的最佳浓度。
5)通过以上方法的筛选,发现在G418的浓度600μg/m L以下的培养皿中浓度越低存活的细胞越多;G418的浓度在600μg/m L以上的培养皿中胚胎细胞接近全部死亡,并且浓度越高,牙鲆胚胎细胞存活时间越短。最终选择600μg/m L的G418为筛选牙鲆胚胎细胞的最佳浓度(见图2)。
3.制备脂质体和外源DNA质粒复合物
1)吸取3ul3000试剂加入50ul的培养基中充分混匀;
2)吸取1ug的外源DNA质粒试剂加入50ul的培养基中稀释DNA,制备DNA预混液,然后添加2ul的P3000TM试剂充分混匀;
3)把已稀释的3000试剂中加入稀释的DNA(1:1比例);然后迅速吹吸混匀,室温孵育5分钟即可形成脂质体‐DNA复合物。
4.转染牙鲆胚胎细胞
1)取牙鲆胚胎细胞以1.0×105个/孔接种于12孔板,待细胞融和度达80%时,按照3000转染试剂说明书进行对牙鲆胚胎细胞转染。
2)将脂质体‐DNA复合物缓缓加入细胞培养基中孵育6h,更换为含10%FBS的DMEM培养液培养,1~2d后,荧光检测转染效率为20%(见图3)。
5.G418筛选牙鲆阳性胚胎细胞
1)对转染后检测具有绿色荧光的培养孔,应用600μg/m L的G418进行筛选,每隔3d换含有相同浓度G418的培养液1次,筛选15天左右,荧光倒置显微镜下观察,可见阴性对照细胞几乎全部死亡(见图4)。
2)之后更换为含有300ug/mL G418的DMEM/F12对阳性细胞进行富集,同2)在富集的过程中每隔3d换含有相同浓度G418的培养液1次,进而获得大量能够稳定表达绿色荧光的牙鲆胚胎细胞。
6.外源基因整合检测
1)对富集的牙鲆阳性细胞进行正常传代培养,传至20代,约两个月的时间(每隔3天传一代),荧光检测仍能看到很亮的荧光(见图5),说明外源EGFP已经能在牙鲆胚胎细胞中稳定的表达。
2)针对转基因质粒的β‐actin启动子区和EGFP基因区设计特异性PCR引物,提取筛选出来的阳性细胞株DNA做模板,进行PCR扩增,能扩增出质粒上的特异性片段,从基因层面说明外源EGFP可以在牙鲆胚胎基因中稳定存在(见图6)。
通过以上检测说明通过本方法成功构建出稳定转基因的牙鲆胚胎细胞株。
- 还没有人留言评论。精彩留言会获得点赞!