一种用于以实时荧光RT‑PCR检测样品中HIV‑1病毒的引物对和包含其的试剂盒的制作方法
本发明涉及生物检测领域,更具体地涉及一种用于检测hiv-1病毒载量的引物序列,以及含有所述引物序列的试剂盒。
背景技术:
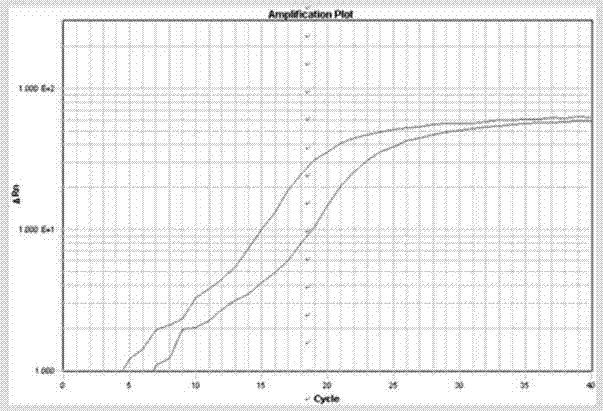
:人免疫缺陷病毒(又称艾滋病病毒,hiv病毒)是造成艾滋病的主要病原体,其属于逆转录病毒科慢病毒属(lentiviruses)中的灵长类慢病毒群(weissetal.,1993,doueketal.,2009),基因组为两条相同的正链rna。常见的艾滋病病毒株有两种,即hiv-1和hiv-2两种类型。其中hiv-1型起源于中非,以后扩散到地中海地区、欧美地区,是引起全球性艾滋病蔓延的主要病原体(gilbertetal.,2003,),hiv-2型主要分布于西部非洲,毒力较弱,引起的aids病程长且症状轻。根据世界卫生组织(who)统计,2011年全球共约3400万名艾滋病病毒携带者和艾滋病患者,每年约有200万人死于aids,同时又有270万人新感染hiv,死亡人数中妇女和儿童占了一半以上,这给世界带来了巨大的危害。目前,hiv病毒的检测有基于抗体的检测和基于核酸的检测、质谱分析和测序等方法。为了达到最大可能的准确性,hiv抗体检测分为筛查、复检和确认三个步骤,筛查、复检呈阳性反应的标本需要经过确认以后才能下结论,这是一个繁冗和耗时的过程。基于核酸的检测主要包括rt-pcr、恒温扩增和实时荧光定量pcr等。实时荧光定量pcr检测方法灵敏度高,特异型强,操作也非常简单,在当前hiv检测中应用非常广泛。实时荧光定量pcr是在普通pcr技术的基础上,在扩增反应体系中加入一对特异性引物的同时再加入一个特异性的荧光探针,使用实时监测的荧光pcr检测仪来检测靶核苷酸序列的技术。除了具有普通pcr的优点外,它还具有以下优点:(1)特异性更强,灵敏度更高。由于多使用了一条可与模板互补配对的荧光探针,提高了特异性,并且由自动化仪器收集荧光信号,避免了人工判断的主观性,又可进一步提高灵敏度;(2)全封闭反应,在线式实时监测荧光,无须pcr产物的后处理,避免污染,保证了结果的可靠性;(3)数据分析选在核酸扩增的对数期,摈弃普通pcr方法的受多因素干扰的终点分析法,使得定量更准确可靠;(4)不接触有毒试剂,操作安全;(5)有利于规模化、自动化及联网管理;(6)适用范围更广,理论上可检测任何病毒的核酸。hiv病毒的逆转录酶因为缺乏校正修复功能,导致其变异频率非常高。不同亚型病毒包膜糖蛋白的氨基酸序列之间的差异在25%–35%之间,即使在某一特定亚型中包膜糖蛋白的氨基酸序列也存在高达20%的差异。针对hiv病毒的高变异性以及艾滋病流行趋势的严重性,还需要开发新的灵敏度高、特异性好的实时荧光pcr检测引物以及相应的检测产品。技术实现要素:本发明的目的在于两个方面:一方面提供一种用于检测hiv-1病毒载量的荧光引物,以及含有该荧光引物的用于以实时荧光rt-pcr检测样品中hiv-1病毒的试剂盒。另一方面提供一种用于检测hiv-1病毒载量的引物对和探针序列,以及含有该引物对和探针的用于以实时荧光rt-pcr检测样品中hiv-1病毒的试剂盒。为了实现上述目的,本发明采用了以下的技术方案:本发明提供一对核苷酸序列,其特异性结合hiv-1病毒,可用作检测hiv-1病毒的引物对,所述引物对由上游引物和下游引物组成,所述上游引物包含seqidno.1所示的核苷酸序列,所述下游引物包含seqidno.2所示的核苷酸序列:seqidno.1ggggtacagtgcaggggaaagaa;seqidno.2taaacccgaaaattttgaatt。优选的,所述上游引物的核苷酸序列如seqidno.1所示,所述下游引物的核苷酸序列如seqidno.2所示。优选的,所述上游引物为荧光标记的引物(在本文中又称为“hfman引物”),其中,所述上游引物的3’端标记有荧光报告基团,所述上游引物的5’端标记有荧光淬灭基团;或者所述上游引物的3’端标记有荧光淬灭基团,5’端标记有荧光报告基团;所述下游引物包含seqidno.2所示的核苷酸序列。优选的标记方式是:所述上游引物的3’端标记有荧光报告基团,所述上游引物的5’端标记有荧光淬灭基团。优选的,所述荧光报告基团为选自fam、hex、texasred、tet、joe、tamra、rox、lcred610、lcred640和cy5中的一种或多种;更优选为fam。优选的,所述荧光淬灭基团为选自bhq1、eclipse、bhq3、bhq2、dabcyl和tamra中的一种或多种;更优选为bhq1。优选的,所述上游引物的3’端标记有荧光发射基团fam,5’端标记有荧光淬灭基团bhq1。本发明还提供一种特异性结合hiv-1病毒的引物对,所述引物对由上游引物和下游引物组成,所述上游引物包含seqidno.3所示的核苷酸序列,所述下游引物包含seqidno.2所示的核苷酸序列::seqidno.3gacagcagtacaaatggcag。优选的,所述上游引物的核苷酸序列如seqidno.3所示,所述下游引物的核苷酸序列如seqidno.2所示。本发明还提供一种用于检测hiv-1病毒的探针(在本文中又称为“taqman探针”),所述探针包含seqidno.1所示的核苷酸序列。优选的,所述探针的核苷酸序列如seqidno.1所示。还优选的,所述探针的3’端标记有荧光报告基团,所述荧光报告基团为选自fam、hex、texasred、tet、joe、tamra、rox、lcred610、lcred640和cy5中的一种或多种,更优选为fam;所述探针的5’端标记有荧光淬灭基团,所述荧光淬灭基团为选自bhq1、eclipse、bhq3、bhq2、dabcyl和tamra中的一种或多种,更优选为bhq1。本发明所述的引物对和所述的探针用于检测hiv-1病毒,所述hiv-1病毒优为人源hiv病毒。基于上述引物对和/或所述探针,本发明提供了两种检测hiv-1病毒的方法:方法一,利用上述特异性的序列如seqidno.1所示的hfman引物和序列如seqidno.2所示的所述下游引物,采用高保真dna聚合酶、反转录酶、四种核苷酸单体(dntp)等成分,应用rt-pcr技术实现待测定hiv-1病毒靶核苷酸序列的核酸片段扩增。其中,所使用的hfman引物的两端分别标记荧光报告基团(r)和荧光淬灭基团(q)。在pcr扩增前,报告基团发射的荧光信号被淬灭基团所吸收;当有目的基因时,hfman引物就会与之结合,高保真dna聚合酶(具有3′→5′外切酶活性)对hfman引物3’末端修饰的荧光报告基团进行识别和切割,使pcr反应正常扩增;同时由于切割作用,荧光报告基团远离淬灭基团,就会产生荧光信号,荧光信号就可以由仪器检测到,并且荧光信号量的变化与扩增产物量成正比,从而判定待测样本中靶核苷酸序列的存在。方法二,利用上述特异性的序列如seqidno.3所示的上游引物、序列如seqidno.2所示的下游引物和所述特异性taqman探针,采用taq酶(耐热dna聚合酶)、反转录酶、四种核苷酸单体(dntp)等成分,同样也应用rt-pcr技术实现待测定hiv-1病毒靶核苷酸序列的核酸片段扩增。其中,所使用的taqman探针为两端分别标记荧光报告基团(r)和荧光淬灭基团(q)的寡核苷酸。在探针完整时,报告基团发射的荧光信号被淬灭基团所吸收,而在pcr扩增过程中,taq酶的5’端外切酶活性将特异性结合在靶核苷酸片段上的荧光探针酶切降解,使荧光报告基团游离于反应体系中。由于脱离了荧光淬灭基团的屏蔽作用,该荧光报告基团的荧光信号就可以由仪器检测到,并且荧光信号量的变化与扩增产物量成正比,从而判定待测样本中靶核苷酸序列的存在。在本发明中,荧光标记的序列如seqidno.3所示的核苷酸序列,既可以作为方法一的探针,又可以作为方法二的上游引物。与方法二比较,方法一省去了特异性探针,因此更简洁,是本发明优选的方法。因此,本发明提供一种用于以实时荧光定量rt-pcr检测样品中hiv-1病毒的试剂盒,所述试剂盒包括:(1)上述的序列如seqidno.1所示的hfman引物和序列如seqidno.2所示的所述下游引物。明显的,该试剂盒适用于所述方法一。本发明提供还一种用于以实时荧光定量rt-pcr检测样品中hiv-1病毒的试剂盒,所述试剂盒包括:(1)上述的序列如seqidno.3所示的所述上游引物和序列如seqidno.2所示的所述下游引物;(2)上述的taqman探针。显然,该试剂盒适用于所述方法二。优选的,上述两种试剂盒还包括以下中的一种或多种:(a)dntps;(b)pcr反应缓冲液;(c)mg2+;(d)高保真dna聚合酶或taq酶;(e)反转录酶;进一步优选地,上述试剂盒还包括以下中的一种或多种:(f)样品rna提取试剂;(g)阴性质控品,为水,优选为depc水;和(h)阳性质控品,为hiv-1病毒rna片段,优选为1×105拷贝/μl的hiv病毒rna片段。优选的,所述高保真dna聚合酶是具有3’-5’外切酶活性的dna聚合酶,为选自pfudna聚合酶、hsdna聚合酶、kod酶、q5tm超保真dna聚合酶、phi9dna聚合酶和klenow酶中的一种。优选的,所述样品为选自全血、血浆、淋巴细胞富集液、外周血淋巴细胞和滤纸干血斑中的一种或多种。所述样品rna提取试剂可以是酚/氯仿/异戊醇法所使用的试剂,也可以是商购的rna提取试剂。优选的,在采用所述试剂盒进行hiv-1病毒检测时,rt-pcr扩增的反应体系以25μl计包含如下主要组分:(1)上述的引物对的荧光标记的上游引物(hfman引物)0.1μmol/l;(2)上述的引物对的下游引物0.4μmol/l;(a)高保真dna聚合酶0.5u(b)反转录酶3.5u;(c)水,优选为depc水,将反应体系补至25μl。除上述主要成分外,实现本发明所述rt-pcr反应,还需要其它成分,如pcr反应缓冲液、dntps、mg2+等,这些组分和高保真dna聚合酶一起可以采用商业化的预混液,如2×pcrmastermix。或者所述rt-pcr扩增的反应体系以25μl计包含如下主要组分,(1)上述的序列如seqidno.3所示的所述上游引物和序列如seqidno.2所示的所述下游引物各0.4μmol/l;(2)上述的taqman探针0.1μmol/l;(a)taq酶2.5u;(b)反转录酶3.5u;(c)水,优选为depc水,将反应体系补至25μl。除上述主要成分外,实现本发明所述rt-pcr反应,还需要其它成分,如pcr反应缓冲液、dntps、mg2+等,这些组分可以和taq酶一起采用商业化的预混液,如2×taqpcrmastermix。优选的,所述rt-pcr的扩增反应条件为:50℃逆转录30min,1个循环;92℃3min,1个循环;92℃10s,55℃-68℃30s,45个循环。上述55℃-68℃为rt-pcr扩增的复性和延伸阶段,在此阶段采集荧光信号。本文提供的试剂盒的检测原理是:利用上述荧光标记的特异性引物,或者一对非荧光标记的特异性引物和一个特异性荧光探针,在包含逆转录酶、高保真dna聚合酶(或taq酶)、脱氧核糖核苷三磷酸以及镁离子等rt-pcr反应缓冲液中,扩增待检测样品中的hiv-1病毒,通过多种市售荧光pcr扩增仪实现靶核苷酸的循环扩增和实时监测,从而快速、灵敏地检测样品中的hiv-1病毒。与现有技术相比,本发明的技术方案具有以下优点:(1)本发明对大量hiv-1基因组序列进行比较分析,针对hiv-1病毒基因组中相对保守的整合酶(in)序列区段,进行引物和探针的设计和筛选,避免了假阴性结果的产生。(2)本发明提供的引物对于hiv-1的rna发生特异性扩增,而对含其它病毒的检测样本均无扩增信号,说明其具有良好的特异性。(3)本发明以特异性的引物对为基础,提供了两种实时荧光rt-pcr检测方法,其一是遵循引物对-荧光探针的思路,其二是首次创新性地对上游引物进行荧光标记,而后将荧光标记的上游引物和非荧光标记的下游引物组成引物对用于hiv-1病毒的检测。本发明提供的引物对-探针的检测灵敏度为300个拷贝/反应,令人意想不到的是,本发明的荧光引物对的检测灵敏度达到30个拷贝/反应。另外,在下面的实施例6中示出的临床检测应用中,引物-探针的试剂盒出现了假阴性的检测结果,而荧光引物的试剂盒7份阳性血液样品全部检测出了病毒载量。说明本发明提供的荧光引物rt-pcr试剂盒避免了引物-荧光探针的假阴性,提高了检测的准确性,改进了引物-荧光探针试剂盒的不足。本发明为实时荧光rt-pcr检测hiv-1病毒提供了一种设计更简洁、反应体系组成更简单、成本更低、灵敏度更高的新思路。(4)由于本发明采用荧光rt-pcr技术作为检测方法,整个反应均在封闭的反应管内进行,避免了其他核酸检测方法如pcr-电泳等易于形成气溶胶污染而造成假阳性结果。并且,由于对rt-pcr产物进行实时监测,大大节省了监测时间,节约了人力物力。(5)本发明提供的试剂盒,可以用于快速、高通量检测hiv-1病毒,大大缩短检测周期,在控制人和非人源性相关生物制品的质量及进出口动物检验检疫领域中具有较大的实际意义,能够保证相关生物制品的品质,控制hiv病毒的传播。本发明提供的试剂盒可用于临床病人和生物制品中hiv-1病毒的检定,应用前景广阔。附图说明下面结合附图对本发明做进一步的说明。图1显示了实施例3中检测hiv-1病毒拷贝数的灵敏度的荧光rt-pcr扩增图;其中图1a是实施例1的反应体系和方法测出的扩增图,图1b是实施例2的反应体系和方法测出的扩增图。图2显示了实施例4中检测引物特异性的荧光rt-pcr扩增图,其中标号为1、2和3的曲线是分别hiv-ae、hiv-b和hiv-bc的扩增曲线。图3显示了实施例5建立的定量检测hiv病毒标准曲线,其中:“■”代表实施例1建立的反应体系,标准曲线的线性方程为:y=-3.546x+43.596,r2=0.9986;“▲”代表代表实施例2建立的反应体系,标准曲线的线性方程为:y=-3.565x+39.599,r2=0.999。图4显示了实施例6中本发明的两种试剂盒临床检测hiv-1病毒载量的结果,其中“■”代表试剂盒i,“□”代表试剂盒ii。图5显示了实施例7中本发明的试剂盒ii与罗氏hiv-1商业化试剂盒检测hiv-1病毒载量结果比较,其中:图5a是两种试剂盒检测结果的回归曲线,图5b是两种试剂盒检测结果的bland-atlman分析,上下两条虚线代表95%一致性界限的上下限,95%一致性界限为1.03和-1.13log10copies/ml,中间实线代表检测结果差值的均数。图6显示了实施例8中本发明的试剂盒i和试剂盒ii在abi7900ht荧光定量机器上的荧光rt-pcr扩增图;其中图6a是试剂盒i的扩增图,图6b是试剂盒ii的扩增图。具体实施方式以下参照具体的实施例来说明本发明。本领域技术人员能够理解,这些实施例仅用于说明本发明,其不以任何方式限制本发明的范围。应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的药材原料、试剂材料等,如无特殊说明,均为市售购买产品。其中一些试剂的制造商信息如下:2×taqmastermix:天根生化科技(北京)有限公司;2×mastermix:neb公司;逆转录酶(amvrtase):生工生物工程(上海)股份有限公司。实施例1引物和探针设计以及反应体系的建立和优化1.引物和探针的设计:获得genbank所有hiv-1的整合酶基因序列,进行序列比对以及序列分析,寻找保守区域,选择了hiv-1病毒保守性较高的序列4606bp-4970bp区段,基于此进行引物设计。体外转录:hiv-1病毒质粒模板(pgh-newvector)由上海捷瑞生物工程有限公司合成,序列为4606bp-4970bp区段,序列如seqidno:4所示,用特异性引物对hiv病毒质粒模板进行扩增,扩增产物用2%的琼脂糖凝胶进行电泳分析,确定大小正确后对目的条带切胶回收,纯化的rna产物就可作为体外转录的模板。体外转录使用promega的“ribomaxlargescalernaproductionsystem-t7”试剂盒,反应过程采用试剂制造商提供的方法。体外转录rna产物使用nanodrop进行浓度和纯度测量,将单位换算成copies/μl(拷贝/μl)。为避免rna反复冻融,取适量稀释至1×1010copies/μl进行分装,并置-80℃保存。对设计出的多对引物和探针用所建立的rt-qpcr(syto9染料法)检测体系进行筛选,得到特异性强、灵敏度高的最优引物对、探针组合,核苷酸序列如下:上游引物(seqidno.3):gacagcagtacaaatggcag;下游引物(seqidno.2):taaacccgaaaattttgaatt;taqman探针(seqidno.1):ggggtacagtgcaggggaaagaa。对所述探针的核苷酸序列进行荧光标记,其中3’端标记荧光报告基团fam,5’端标记荧光淬灭基团bhq1,得到荧光标记的taqman探针:taqman探针:5’-bhq1-ggggtacagtgcaggggaaagaa-fam-3’2.基于taqman探针的实时荧光rt-pcr反应体系的建立和优化:hiv-1病毒rna片段由中科院上海巴斯德研究所体外反转录合成。2.1引物浓度的优化在反应体系中,将hiv-1的引物浓度分别从0.4μmol/l至0.1μmol/l作倍比连续稀释后进行检测,通过试验结果的分析比较,确定最佳引物终浓度为0.4μmol/l。2.2taqman探针浓度的优化在反应体系中,将hiv-1的探针浓度分别从0.4μmol/l至0.1μmol/l作倍比连续稀释后进行检测,通过试验结果的分析比较,确定最佳探针终浓度为0.1μmol/l。利用上述引物(非荧光标记)、taqman探针进行反应体系的建立,最后确定采用的实时荧光rt-pcr反应体系为25μl体系,所需各组分及相应浓度见表1。表1优化后的引物(非荧光标记)-探针rt-pcr反应体系组分终浓度上游引物(seqidno.3)0.4μmol/l下游引物(seqidno.2)0.4μmol/ltaqman探针(seqidno.1)0.1μmol/l2×taqmastermixa1×反转录酶3.5urna模板3μl在加入模板后,补水至25μla:2×taqmastermix,含有2×taq酶(在上述反应体系中的终浓度为2.5u)、2×pcr反应缓冲液、2×dntps、mg2+。本领域技术人员应当知晓:在荧光rt-pcr反应体积不同时,各试剂应按比例调整;使用的仪器不同,应将反应参数作适当调整。3.仪器检测通道的选择:在进行荧光rt-pcr反应时,应对所用仪器中反应管荧光信号的收集进行设置,选择的荧光检测通道与探针所标记的荧光报告基团一致。具体设置方法因仪器而异,应参照仪器使用说明书。4.优化的rt-pcr条件如下:50℃逆转录30min,1个循环;92℃3min,1个循环;92℃10s,55℃-68℃,30s,45个循环;在55℃-68℃复性和延伸阶段采集荧光信号。实施例2荧光标记引物的设计和反应体系的建立和优化1.荧光标记引物的设计在实施例1设计得到的一对特异性引物和探针的基础上,经试验发现,以taqman探针(荧光标记)为上游引物,和核苷酸序列如seqidno.2所示的下游引物组成引物对,不仅可以实现特异性靶核苷酸的扩增,并且荧光信号量的变化与扩增产物量成正比。因此,本实施例的荧光rt-pcr反应体系仅包括荧光标记的上游引物(hfman引物)和下游引物,核苷酸序列为:hfman引物:5’-bhq1-ggggtacagtgcaggggaaagaa-fam-3’;下游引物(seqidno.2):taaacccgaaaattttgaatt。2.反应体系的建立和优化步骤同实施例1的“2.反应体系的建立和优化”。最后确定采用的荧光rt-pcr反应体系为25μl体系,所需各组分及相应浓度见表2。表2优化后的荧光标记引物rt-pcr反应体系a:2×mastermix含有2×高保真dna酶(在上述反应体系中的终浓度为0.5u)、2×pcr反应缓冲液、2×dntps、mg2+。本领域技术人员应当知晓:在荧光rt-pcr反应体积不同时,各试剂应按比例调整;使用的仪器不同,应将反应参数作适当调整。3.仪器检测通道的选择:同实施例1的“3.仪器检测通道的选择”。4.优化的rt-pcr条件同实施例1的“4.优化的rt-pcr条件”。实施例3实施例1和实施例2建立的反应体系和实时荧光rt-pcr方法检测hiv-1病毒的拷贝数的灵敏度试验使用无rnase的h2o分别对hiv-1病毒体外转录得到的rna模板进行梯度稀释,得到浓度依次为1×107、1×106、1×105、1×104、1×103、1×102、1×101和1×100拷贝/μl的rna模板,分别使用实施例1和实施例2中1-4步骤设计的引物、探针以及建立的优化反应体系和扩增条件,分别在roche(lightcycle96)荧光机器上进行实时荧光rt-pcr检测。结果表明,rna模板的浓度为1×107、1×106、1×105、1×104、1×103、1×102和1×101拷贝/μl时,实施例1和实施例2的反应体系都出现了扩增曲线,说明两个反应体系的灵敏度较高。实施例1的反应体系和方法,检测300个拷贝/反应(3×102拷贝)和30个拷贝/反应(3×101拷贝)时,扩增曲线几乎一样,见图1a。而实施例2的反应体系和方法在cq值<45,荧光阈值0.05以上,出现了明显的“对数曲线s”形状扩增曲线,表示hiv-1病毒在该浓度下有扩增;用该方法可以检测出30个拷贝/反应(3×101拷贝),见图1b。说明实施例2的反应体系和方法灵敏度比实施例1更高。结果见图1a和图1b。另外,从图1a和图1b也可以看出,在相同拷贝数下,实施例2的方法检测出的扩增曲线(图1b所示出)也明显好于实施例1的扩增曲线(图1a所示出)。说明实施例2的方法对hiv-1的扩增效果更好。实施例4本发明设计的引物特异性评估试验样品:(1)健康人血液rna(2)hiv3种亚型:hiv-b、hiv-ae、hiv-bc(3)rsva(vr-26)(4)rsvb(vr-1580)(5)ev(6)adenovirus(vr-930)(7)p2v3(8)hcov-229e(vr-740)(9)hcov-oc43(vr-1558)第(2)-(9)的病毒株均由上海巴斯德研究所提供,购自atcc公司。使用实施例2建立的反应体系和实时荧光rt-pcr方法分别在roche(lightcycle96)荧光机器上对上述待测样品进行检测。结果见图2和表3。表3本发明的引物特异性试验结果图2和表3都示出,本发明设计的引物仅对hiv的rna发生扩增,在pcr反应结束后,有“s”形扩增曲线,对含其它病毒的检测样本均没有扩增信号,说明本发明所述引物具有很高的特异性。实施例5实施例1和实施例2反应体系定量检测hiv-1病毒标准曲线的建立使用无rnase的h2o分别对hiv病毒体外转录得到的rna模板进行梯度稀释,得到浓度依次为1×107、1×106、1×105、1×104、1×103、1×102拷贝/μl的rna模板,使用实施例1和实施例2优化好的最佳体系和步骤,分别在roche(lightcycle96)荧光机器上进行检测,并进行标准曲线制作。实验结果如图3所示,两种方法检测hivrna在107-102拷贝/μl间都有很好的线性关系。其中,实施例1的实时荧光定量方法检测hiv标准曲线线性方程为:y=-3.546x+43.596,r2=0.9986。实施例2的实时荧光定量方法检测hiv标准曲线线性方程为:y=-3.565x+39.599,r2=0.999。两种方法检测hiv的线性系数都接近于1,表明线性关系都很好,且两者的扩增效率分别为1.95和2.01。实施例6本发明的试剂盒在临床检测中的应用1.样本:7份hiv阳性临床血液样本。样本处理:离心分离血浆,-80℃冰箱保存待测。2.检测条件试剂:本发明提供的试剂盒i,包括:(1)实施例1所述的上游引物和下游引物;(2)taqman探针;(3)dntps(含dutp);(4)pcr反应缓冲液;(5)mg2+;(6)taq酶;(7)反转录酶;和(8)hiv-1病毒rna提取试剂,为qiagenviralrnaminikit的rna提取试剂盒。本发明提供的试剂盒ii,包括:(1)hfman引物;(2)实施例1中所述的下游引物;(3)dntps(含dntp);(4)10×pcr反应缓冲液;(5)mg2+;(6)高保真nda聚合酶;(7)反转录酶;和(8)hiv-1病毒rna提取试剂,为qiagenviralrnaminikit的rna提取试剂盒。仪器:roche(lightcycle96)荧光定量仪。3.反应模板的提取每个样品取140μl的血浆,使用qiagenviralrnaminikit对样本进行hiv病毒rna抽提,最后用60μl的无核酸酶的水进行洗脱,洗脱液即为反应模板。4.检测程序实时荧光qrt-pcr反应体系为25μl体系,主要组分浓度见表4,其它组分来源于适宜的商购pcr预混液。表4rt-pcr反应体系在roche(lightcycle96)荧光机器上进行检测。rt-pcr条件为:50℃逆转录30min,1个循环;92℃3min,1个循环;92℃10s,55℃-68℃,30s,45个循环;在55℃-68℃复性和延伸阶段采集荧光信号。5.检测结果两种试剂盒病毒载量检测结果如图4所示(病毒载量是指每毫升血浆中病毒颗粒的数量)。从图4中可看出,试剂盒i检测出了4个样本,出现了假阴性结果;试剂盒ii检测出了全部7个样本。而且采用试剂盒ii检测出的病毒载量要稍微高于试剂盒i检测的结果。上述结果说明,试剂盒的特异性和准确性高于试剂盒i。实施例7试剂盒ii和商业化试剂盒的比较21份hiv阳性临床样品(包括b、ae、bc三种hiv类型),每个样品分为两份,一份经罗氏cobasampliprep/cobastaqman系统进行自动化抽提和病毒载量测定。另一份经过与实施例6相同的方法抽提rna并制作反应模板,采用实施例6中的试剂盒ii进行病毒载量检测,将两次的结果进行如下比较。1.以试剂盒ii检测的病毒载量结果横坐标,罗氏商业试剂盒的检测结果为纵坐标,将两种方法测定的病毒载量结果进行线性回归分析,结果见图5a。两种方法的线性公式为:y=0.835x+0.707,r2=0.7859;表明两者相关性较大。2.对两种方法检测结果进行bland-altman分析。用横轴表示两种方法病毒载量检测结果的平均值,纵轴表示两种方法病毒载量检测结果的差值,结果见图5b。21份样品中20份样品两种方法测定的差值都在95%一致性界限内。说明两种方法测定的结果一致性好。以上结果表明,两种方法的检测效果相当,说明本发明的rt-qpcr体系和方法的灵敏性、准确率和检测效果均佳。实施例8试剂盒i和试剂盒ii在abi7900ht荧光定量机器上的应用在abi7900ht荧光定量机器上,分别使用实施例6中的试剂盒i和试剂盒ii,待测样品为体外转录的hiv的rna标准品(107和106拷贝/ul)检测结果见图6a和图6b。图6示出,两种试剂盒在abi7900ht荧光定量机器都示出了扩增曲线。说明本发明的rt-qpcr体系和方法适用范围广,可以应用于多种荧光定量仪(机器)。在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。序列表<110>张梦玲<120>一种用于以实时荧光rt-pcr检测样品中hiv-1病毒的引物对和包含其的试剂盒<130>2017140<160>4<170>patentinversion3.3<210>1<211>23<212>dna<213>人工序列<400>1ggggtacagtgcaggggaaagaa23<210>2<211>21<212>dna<213>人工序列<400>2taaacccgaaaattttgaatt21<210>3<211>20<212>dna<213>人工序列<400>3gacagcagtacaaatggcag20<210>4<211>227<212>dna<213>hiv-1病毒基因序列<400>4caggctgaacatcttaagacagcagtacaaatggcagtattcatccacaattttaaaaga60aaaggggggattggggggtacagtgcaggggaaagaatagtagacataatagcaacagac120atacaaactaaagaattacaaaaacaaattacaaaaattcaaaattttcgggtttattac180agggacagcagagatccagtttggaaaggaccagcaaagctcctctg227-1-当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种转基因鲑鱼AquAdvantage品系特异性实时荧光PCR检测引物、检测方法和试剂盒与流程
- 犬圆环病毒的实时荧光PCR检测用引物及检测方法与流程
- 用于荧光学图像的检测和实时显示的荧光学系统的制作方法与工艺
- 用于荧光学图像的检测和实时显示的荧光学系统的制作方法与工艺
- 利用单拷贝核基因检测食品和饲料中牛源性成分的实时荧光PCR检测方法与流程
- H10N7禽流感病毒的实时荧光PCR检测试剂盒及检测方法与流程
- 多重实时荧光PCR检测Cr(VI)还原复合菌群六种功能基因的方法与流程
- 刺苋的实时荧光PCR鉴定方法与流程
- 一种猪肺炎支原体的实时荧光PCR检测试剂盒及其用途的制作方法与工艺
- 实时荧光PCR特异性检测远志的引物及检测方法与流程
- 一种特异性引物检测鼠源性成分的方法与制造工艺
- 一组用于驴源性的实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一组用于鸡源性实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一种燕窝制品的实时荧光定量PCR鉴定试剂盒及其鉴定方法与制造工艺
- 一种具有移液功能的荧光定量PCR仪的制造方法与工艺
- 一种基于多灾种实时耦合的化工园区实时定量风险评估方法与制造工艺
- 一种实时荧光定量PCR检测方法及其标准品和检测试剂盒与制造工艺
- 检测外周血CAR‑T细胞的TaqMan实时荧光定量PCR试剂盒的制造方法与工艺
- 一种实时荧光定量PCR检测土壤西瓜枯萎病菌的方法及引物与制造工艺
- 一种基于反射镜的荧光定量PCR的检测系统的制造方法与工艺
- 一种基于荧光定量PCR鉴定啮齿类螺杆菌的引物、试剂盒及鉴定方法与流程
- 一种检测包含潜伏期结核感染的试剂盒及其引物对和探针的制造方法与工艺
- 用于甜瓜果实基因PCR表达分析的内参基因及该内参基因的稳定性验证方法与流程
- 一种特异性引物检测鼠源性成分的方法与制造工艺
- 一组用于驴源性的实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一组用于鸡源性实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一种燕窝制品的实时荧光定量PCR鉴定试剂盒及其鉴定方法与制造工艺
- 一种具有移液功能的荧光定量PCR仪的制造方法与工艺
- 一种基于多灾种实时耦合的化工园区实时定量风险评估方法与制造工艺
- 一种实时荧光定量PCR检测方法及其标准品和检测试剂盒与制造工艺