基于反向扩增全长质粒和In-fusion连接的快速克隆方法与流程
本发明属于生物技术,尤其涉及一种基于反向扩增全长质粒和in-fusion连接的快速克隆方法。
背景技术:
传统的基因克隆技术始于70年代初期,包括一系列技术,主要包括载体选择、目的dna片段的获得、体外重组、导入受体细胞及阳性克隆筛选等步骤。该技术实施过程中需要根据载体选择合适的酶切位点,根据已知序列设计相应的引物,从基因组dna或cdna中通过聚合酶链式反应(polymerasechainreaction,pcr)获得目的基因,并使得载体与目的基因用相同的限制性内切酶酶切后,在体外通过t4dna连接酶的作用形成重组体,继而因载体dna分子上具有能被原核宿主细胞识别的复制起始位点,因此可以在原核细胞如大肠杆菌中复制,重组载体中的目的基因随同载体一起被扩增,获得大量同一的重组dna分子,最后通过pcr或者限制性内切酶酶切法等手段鉴定目的基因大小,获得的阳性克隆经基因测序分析,最终确认目的基因。
近年来,随着分子生物学的飞速发展,诸多公司发展了一系列商业性克隆手段,如由invitrogen公司(sandiego,ca)发展而来的商业性试剂盒ta克隆系统,它用于pcr产物的克隆和测序。ta克隆系统的原理为:利用taq酶能够在pcr产物的3’末端加上一个非模板依赖的a,而t载体是一种带有3’t突出端的载体,在连接酶作用下,可以快速地、一步到位地把pcr产物直接插入到质粒载体的多克隆位点(mcs)中。如takara公司开发的in-fusion克隆试剂盒,利用pcr产物和线性载体末端的15bp重叠序列,in-fusion酶可以高效准确地将pcr产物和线性载体融合在一起。可以通过设计引物来扩增得到15bp重叠序列。该方法无需亚克隆即可将单片段或多片段克隆到单一载体,可将任一pcr片段或多个片段方向性、无缝地克隆到任何线性载体上。而随着基因定向进化的诸多需求,人们也大力发展了定点突变基因克隆手段,如stratagene公司开发的定点突变试剂盒,就是基因在突变位点设计一对引物,通过反向扩增全长质粒获得目的基因,通过dpnⅰ限制性内切酶消化受甲基化保护的原模板,无需任何纯化步骤,即可直接进行体外导入宿主细胞筛选阳性克隆,该方法大大缩短了克隆时间,并实现了高阳性克隆率。takara公司的in-fusion克隆方法,虽然简化了连接时间,但在克隆上仍需使用多轮pcr或者重叠延伸pcr获得目的片段,而载体的线性化必须依赖限制性内切酶进行酶切,工艺仍然较为繁琐。
技术实现要素:
本发明的目的在于提供一种基于反向扩增全长质粒和in-fusion连接的快速克隆方法,旨在解决传统基因克隆技术中须依赖pcr、酶切、连接及转化等多个繁琐手段,且获得的阳性率往往较低的问题。
为实现上述发明目的,本发明采用的技术方案如下:
本发明一方面提供一种快速克隆方法,包括以下步骤:
设计用于扩增目的基因的第一引物对和用于扩增载体模板的第二引物对;其中,所述第一引物对包括第一上游引物和第一下游引物,第一上游引物包括末端重叠序列a,第一下游引物包括末端重叠序列b;所述第二引物对包括第二上游引物和第二下游引物,第二上游引物包括末端重叠序列b’,第一下游引物包括末端重叠序列a’,且所述末端重叠序列a与所述末端重叠序列a’反向互补,所述末端重叠序列b与所述末端重叠序列b’反向互补;
提供原始载体模板,采用pcr反向扩增技术扩增含有末端重叠序列a和末端重叠序列b的线性化载体,以及采用pcr反向扩增技术扩增含有末端重叠序列a’和末端重叠序列b’的目的基因;
采用连接酶将所述线性化载体的末端重叠序列a和所述目的基因的末端重叠序列a’连接,将所述线性化载体的末端重叠序列b和所述目的基因的末端重叠序列b’连接,得到环状克隆载体;
将所述环状克隆载体导入宿主细胞,进行表达。
本发明提供的快速克隆方法,主要包括引物设计、pcr反相扩增载体与目的片段、in-fusion连接及导入宿主细胞等步骤。该方法通过反向扩增全长质粒和in-fusion快速连接方法并用,一方面,无需考虑任何酶切以及酶切位点,大大减少限制性内切酶使用成本。另一方面,pcr方法反向扩增全长质粒过程中,可以不采用胶回收纯化目的条带,直接用dpnⅰ限制性内切酶消化除去甲基化保护的原模板;而目的基因片段也可以直接省去纯化步骤用于后续in-fusion连接克隆,大大简化了克隆步骤;将所述环状克隆载体导入宿主细胞后,可以省去阳性克隆鉴定步骤(如菌落pcr鉴定等),直接测序即可。由此,明显简化了操作步骤,可以快速构建基因载体,大大缩短克隆时间(4h内完成),阳性克隆率高达95%以上。特别的,针对长目的基因片段中部分基因更换的情况,无需考虑任何酶切位点,减少多轮pcr或重叠延伸pcr步骤,从而减少限制性内切酶使用成本,可以任意的pcr片段或多个片段方向性无缝的克隆到任一载体,从而大大缩短克隆时间,并且阳性克隆率高达95%以上。
综上,本发明提供的快速克隆方法,操作简单,成本低,阳性克隆率高,为各种基因文库的载体构建提供了一种高通量的快速克隆途径。
附图说明
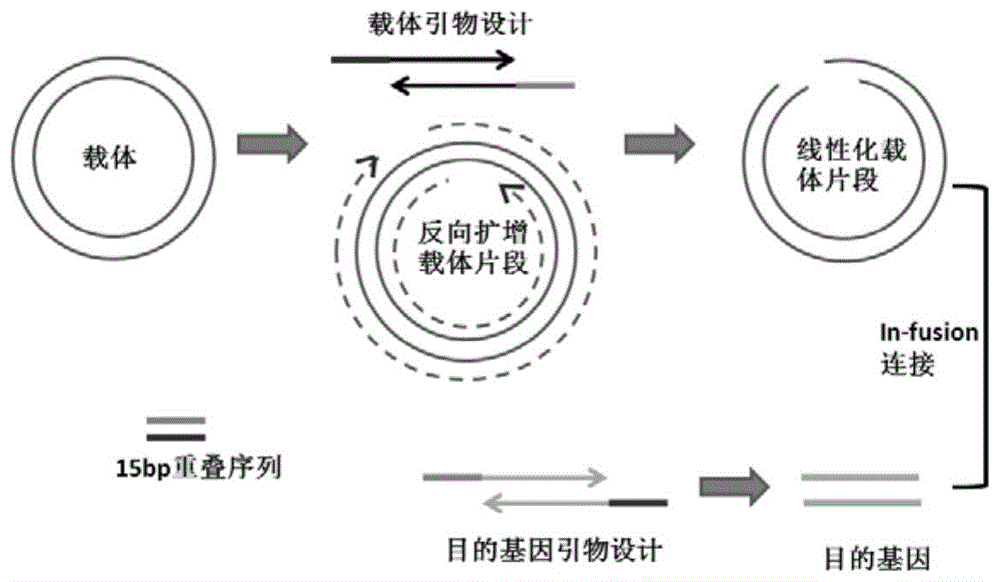
图1是本发明实施例提供的快速克隆方法的流程示意图;
图2是本发明实施例1提供的采用pcr反向扩增技术扩增线性化载体得到的产物进行核算凝胶电泳检测的结果图;
图3是本发明实施例1提供的采用pcr反向扩增技术扩增目的基因得到的产物进行核算凝胶电泳检测的结果图;
图4是本发明实施例1提供的菌落pcr鉴定目的基因片段的结果图;
图5是本发明实施例2提供的采用pcr反向扩增技术扩增线性化载体得到的产物进行核算凝胶电泳检测的结果图;
图6是本发明实施例2提供的采用pcr反向扩增技术扩增目的基因得到的产物进行核算凝胶电泳检测的结果图;
图7是本发明实施例2提供的菌落pcr鉴定目的基因片段的结果图。
具体实施方式
为了使本发明要解决的技术问题、技术方案及有益效果更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
在本发明的描述中,需要理解的是,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括一个或者更多个该特征。在本发明的描述中,“多个”的含义是两个或两个以上,除非另有明确具体的限定。
结合图1,本发明实施例提供一种快速克隆方法,包括以下步骤:
s01.设计用于扩增目的基因的第一引物对和用于扩增载体模板的第二引物对;其中,所述第一引物对包括第一上游引物和第一下游引物,第一上游引物包括末端重叠序列a,第一下游引物包括末端重叠序列b;所述第二引物对包括第二上游引物和第二下游引物,第二上游引物包括末端重叠序列b’,第一下游引物包括末端重叠序列a’,且所述末端重叠序列a与所述末端重叠序列a’反向互补,所述末端重叠序列b与所述末端重叠序列b’反向互补;
s02.提供原始载体模板,采用pcr反向扩增技术扩增含有末端重叠序列a和末端重叠序列b的线性化载体,以及采用pcr反向扩增技术扩增含有末端重叠序列a’和末端重叠序列b’的目的基因;
s03.采用连接酶将所述线性化载体的末端重叠序列a和所述目的基因的末端重叠序列a’连接,将所述线性化载体的末端重叠序列b和所述目的基因的末端重叠序列b’连接,得到环状克隆载体;
s04.将所述环状克隆载体导入宿主细胞,进行表达。
本发明实施例提供的快速克隆方法,主要包括引物设计、pcr反相扩增载体与目的片段、in-fusion连接及导入宿主细胞等步骤。该方法通过反向扩增全长质粒和in-fusion快速连接方法并用,一方面,无需考虑任何酶切以及酶切位点,大大减少限制性内切酶使用成本。另一方面,pcr方法反向扩增全长质粒过程中,可以不采用胶回收纯化目的条带,直接用dpnⅰ限制性内切酶消化除去甲基化保护的原模板;而目的基因片段也可以直接省去纯化步骤用于后续in-fusion连接克隆,大大简化了克隆步骤;将所述环状克隆载体导入宿主细胞后,可以省去阳性克隆鉴定步骤(如菌落pcr鉴定等),直接测序即可。由此,明显简化了操作步骤,可以快速构建基因载体,大大缩短克隆时间(4h内完成),阳性克隆率高达95%以上。特别的,针对长目的基因片段中部分基因更换的情况,无需考虑任何酶切位点,减少多轮pcr或重叠延伸pcr步骤,从而减少限制性内切酶使用成本,可以任意的pcr片段或多个片段方向性无缝的克隆到任一载体,从而大大缩短克隆时间,并且阳性克隆率高达95%以上。
综上,本发明实施例提供的快速克隆方法,操作简单,成本低,阳性克隆率高,为各种基因文库的载体构建提供了一种高通量的快速克隆途径。
具体的,上述步骤s01中,设计用于扩增目的基因的第一引物对和用于扩增载体模板的第二引物对。值得注意的是,用于扩增目的基因的第一引物对的设计,需要设计一段末端重叠序列;用于扩增载体模板的第二引物对,需要设计一段末端重叠序列。所述第一引物对的末端重叠序列与所述第二引物对的末端重叠序列反向互补,从而在下述步骤s03的连接过程中,通过两组末端重叠序列(即四个末端重叠序列),将所述线性化载体与所述目的基因连接,并形成环状克隆载体。
具体的,所述第一引物对包括第一上游引物和第一下游引物,第一上游引物包括末端重叠序列a,第一下游引物包括末端重叠序列b;所述第二引物对包括第二上游引物和第二下游引物,第二上游引物包括末端重叠序列b’,第一下游引物包括末端重叠序列a’,且所述末端重叠序列a与所述末端重叠序列a’反向互补,所述末端重叠序列b与所述末端重叠序列b’反向互补。
优选的,所述末端重叠序列a含有至少15bp。此时,应当理解的是,与所述末端重叠序列a反向互补的末端重叠序列b’,具有与所述末端重叠序列a相同的碱基数,即所述末端重叠序列b’含有至少15bp。
优选的,所述末端重叠序列b含有至少15bp。此时,应当理解的是,与所述末端重叠序列b反向互补的末端重叠序列a’,具有与所述末端重叠序列b相同的碱基数,即所述末端重叠序列a’含有至少15bp。
作为更优选实施例,所述末端重叠序列a含有至少15bp,且所述末端重叠序列b含有至少15bp。此时,通过pcr高保真酶可以高保真的实现载体片段的扩增,进而能够保证下述步骤s03中所述线性化载体的末端重叠序列a和所述目的基因的末端重叠序列a’顺利连接,所述线性化载体的末端重叠序列b和所述目的基因的末端重叠序列b’顺利连接,最终得到环状克隆载体。同时,由于in-fusion特异性15bp重叠,因此通过简单重组即可获得高转化效率,该方法比较简单,只需要在引物设计上设计重叠的15bp序列,仅需要通过pcr方法就可实现线性化载体与目的片段,无需传统的多轮pcr、酶切及胶回收纯化片段等繁琐手段实现线性化,存在操作时间长,使用的pcr酶和限制性内切酶成本高等缺点。在具体实施例中,所述末端重叠序列a含有15bp,且所述末端重叠序列b含有15bp。
本发明实施例中,用于扩增目的基因的第一引物对的设计,除了需要设计一段末端重叠序列,还需要设计目的基因模板引物段;用于扩增载体模板的第二引物对,除了需要设计一段末端重叠序列,还需要设计载体模板引物段。
在一些实施例中,所述第一上游引物中,除所述末端重叠序列a外,还含有18-27bp的模版链,从而保证高效的扩增效果。进一步的,所述第一上游引物中gc碱基的含量在40~60%之间,从而保证pcr快速有效的进行。若gc值的含量太高,难以变性解链,导致无法继续退火延伸,导致pcr反应难以完成。
在一些实施例中,所述第一下游引物中,除所述末端重叠序列b外,还含有18bp~27bp,从而保证较好的扩增效果。进一步的,所述第一下游引物中gc碱基的含量在40~60%之间,从而保证pcr快速有效的进行。若gc值的含量太高,难以变性解链,导致无法继续退火延伸,导致pcr反应难以完成。
在上述实施例的基础上,优选的,所述第一引物的退火温度(tm)为58–65℃,且所述第一上游引物与所述第一下游引物的tm值之差≤4℃,否则,扩增效果不理想。
在上述实施例的基础上,优选的,所述第一引物(包括所述第一上游引物与所述第一下游引物)除所述末端重叠序列外的18bp~27bp不包含连续相同核苷酸,每条引物3’端最后5个核苷酸鸟嘌呤(g)或者胞嘧啶(c)的个数不多于2个,从而避免引物内部及引物间互补序列,以防止引物自身产生发夹结构或者引物与引物之间产生引物二聚体。
在一些实施例中,所述第二上游引物中,除所述末端重叠序列b’外,还含有18bp~27bp,从而保证较好的扩增效果。进一步的,所述第二上游引物中gc碱基的含量在40~60%之间,从而保证pcr快速有效的进行。若gc值的含量太高,难以变性解链,导致无法继续退火延伸,导致pcr反应难以完成。
在一些实施例中,所述第二下游引物中,除所述末端重叠序列a’外,还含有18bp~27bp,从而保证较好的扩增效果。进一步的,所述第二下游引物中gc碱基的含量在40~60%之间,从而保证pcr快速有效的进行。若gc值的含量太高,难以变性解链,导致无法继续退火延伸,导致pcr反应难以完成。
在上述实施例的基础上,优选的,所述第二引物(包括所述第二上游引物与所述第二下游引物)的退火温度(tm)为58–65℃,且所述第二上游引物与所述第二下游引物的tm值之差≤4℃,否则,扩增效果不理想。
在上述实施例的基础上,优选的,所述第二引物(包括所述第二上游引物与所述第二下游引物)除所述末端重叠序列外的18bp~27bp不包含连续相同核苷酸,每条引物3’端最后5个核苷酸鸟嘌呤(g)或者胞嘧啶(c)的个数不多于2个,从而避免引物内部及引物间互补序列,以防止引物自身产生发夹结构或者引物与引物之间产生引物二聚体。
当然,最优选的,所述第一上游引物中,除所述末端重叠序列a外,还含有18bp~27bp,且所述第一上游引物中g、c碱基的含量在40%~60之间;所述第一下游引物中,除所述末端重叠序列b外,还含有18bp~27bp,且所述第一下游引物中g、c碱基的含量在40%~60之间;所述第二上游引物中,除所述末端重叠序列b’外,还含有18bp~27bp,且所述第二上游引物中gc碱基的含量在40%~60之间;所述第二下游引物中,除所述末端重叠序列a’外,还含有18bp~27bp,且所述第二下游引物中g、c碱基的含量在40%~60之间。
本发明实施例中,引物设计的过程中,除了需要考虑设计15bp以上的重叠序列外,不用考虑任何酶切位点,可以进行任意部位的克隆设计,从而简化了克隆方法,提高克隆的便利性。
上述步骤s02中,提供原始载体模板,所述原始载体模板可以是任意载体,包括空载体或者重组质粒。
采用pcr反向扩增技术扩增含有末端重叠序列a和末端重叠序列b的线性化载体,采用pcr反向扩增技术扩增含有末端重叠序列a’和末端重叠序列b’的目的基因,可以针对原始载体模板和目的基因的具体情况,选择合适的扩增反应体系和扩增条件。
经过pcr反向扩增技术扩增得到的目的基因,含有两个末端重叠序列,分别为末端重叠序列a’和末端重叠序列b’;经过pcr反向扩增技术扩增得到的线性化载体,含有两个末端重叠序列,分别为末端重叠序列a和末端重叠序列b。
常规的pcr反应,在反应完成后,需要经核酸凝胶成像电泳检测目的条带,并使用胶回收试剂盒如omegagelextractionkits回收目的条带进行纯化。本发明实施例中,在pcr反向扩增结束后,反向扩增的全长质粒可以省去胶回收纯化步骤,仅采用dpnⅰ酶消化去除甲基化保护的原始载体模板;同时,目的基因片段也可省去纯化步骤,直接用于后续in-fusion连接步骤。由此,大大简化了操作流程,提高了克隆效率。
上述步骤s03中,采用连接酶将所述线性化载体的末端重叠序列a和所述目的基因的末端重叠序列a’连接;同时,将所述线性化载体的末端重叠序列b和所述目的基因的末端重叠序列b’连接,最终得到环化的克隆载体。
通过该步骤处理,无需多轮pcr扩增、多次酶切线性化、多次电泳胶回收纯化等手段,可以明显简化操作步骤,从而快速构建基因载体,大大缩短克隆时间(4h内完成),获得纯度较高的线性化载体和目的片段以期保证高效连接;且由于采用in-fusion连接的方法需要满足至少15bp重叠序列,原始片段的含量减少,所以可以减少多次电泳胶回收纯化步骤,实现高效率的阳性克隆率,阳性克隆率高达95%以上。
在优选实施例中,所述连接酶选自in-fusion酶,所述in-fusion酶是一种能快速、简单、高效的实现连接反应的酶,不受限制化内切酶酶切位点的限制,就可以实现完美的无缝连接。
在一些实施例中,采用连接酶将所述线性化载体的末端重叠序列a和所述目的基因的末端重叠序列a’连接,将所述线性化载体的末端重叠序列b和所述目的基因的末端重叠序列b’连接,得到环状克隆载体的步骤中,反应体系如下:
反应条件为:将所述反应体系混匀后,于45℃~55℃条件下孵育10~20min。
在上述反应体系和反应条件下,可以快速、简单、高效的实现连接反应的酶,不受限制化内切酶酶切位点的限制,就可以实现完美的无缝连接。
上述步骤s04中,将连接产物即环状克隆载体转化导入宿主细胞,优选采用热导入的方式。如在一个具体实施例中,将连接产物即环状克隆载体与宿主细胞dh5α混匀后,在冰上放置30min后,于42℃水浴锅中热激90s,迅速放入冰上降温约2min后,将连接产物快速加入lb培养基中,于37℃摇床震荡200rpm复苏细胞40-60min后,离心后弃去上清lb培养基剩余约50-100μl均匀的涂于相应的抗性板(加入100μg/ml的氨苄抗生素lb平板)上。将平板倒置37℃恒温培养箱培养过夜。
当然,进一步的,可以进行阳性克隆筛选及鉴定。
在一些实施例中,可以挑取平板上的单菌落进行菌落pcr鉴定(引物可采用第一上游引物和第一下游引物)。但本发明实施例提供的快速克隆方法,将所述环状克隆载体导入宿主细胞后,可以省去阳性克隆鉴定步骤(如菌落pcr鉴定等),直接测序即可,大大缩短克隆时间(4h内完成),且阳性克隆率高达95%以上。
本发明实施例提供的快速克隆方法,整个克隆步骤4h内即可完成,其中pcr反向扩增大约90min,载体模板消化20min,in-fusion连接15min,转化约90min,第2天即可测序鉴定,阳性率极高。而按照传统克隆方法,仅克隆步骤至少需要2天的时间。可见,本发明实施例提供的快速克隆方法,可明显缩短克隆时间。
下面结合具体实施例进行说明。
实施例1
一种重组质粒pncs-clover-nluc的快速克隆方法,包括以下步骤:
s11.设计用于扩增目的基因的第一引物对和用于扩增载体模板的第二引物对;其中,所述第一引物对包括第一上游引物和第一下游引物,所述第二引物对包括第二上游引物和第二下游引物,第一上游引物、第一下游引物、第二上游引物和第二下游引物的序列如下,其中,下划线部分为相同的15bp的末端重叠序列;
第二上游引物:
5’
第二下游引物:
5’gctgcctcccgggcgtaaccggatctt3’
第一上游引物:
5’cgcccgggaggcagcgcagaaatcggtactggctt3’
第一下游引物:
5’
s12.提供原始载体模板,采用pcr反向扩增技术扩增含有末端重叠序列a和末端重叠序列b的线性化载体,以及采用pcr反向扩增技术扩增含有末端重叠序列a’和末端重叠序列b’的目的基因;其中,采用pcr反向扩增技术扩增目的基因的反应体系如下:
采用pcr反向扩增技术扩增线性化载体的反应体系如下:
pcr反向扩增的反应条件为:
98℃,10s;
55℃,5sor15s;
72℃,5s/kb,
30-35个循环。
采用dpnⅰ酶消化去除甲基化保护的原始载体模板。
将采用pcr反向扩增技术扩增线性化载体得到的产物进行核算凝胶电泳检测,结果如图2所示,可见本发明实施例方法扩增得到的线性化载体具有很高的纯度;将采用pcr反向扩增技术扩增目的基因得到的产物进行核算凝胶电泳检测,结果如图3所示,可见本发明实施例方法扩增得到的目的基因具有很高的纯度。
s13.采用takara公司的in-fusion酶将所述线性化载体与所述目的基因连接,得到环状克隆载体;具体的,
反应体系如下:
反应条件为:将所述反应体系混匀后,于50℃条件下孵育15min,放置冰上备用。
s14.将所述环状克隆载体导入宿主细胞,进行表达。
挑取平板上的单菌落进行菌落pcr鉴定(引物采用第一上游引物和第一下游引物),结果如图4所示,可见本发明实施例提供了的克隆方法具有极高的阳性率。
实施例2
一种重组质粒pgex-4t-1+ca15-3的快速克隆方法,包括以下步骤:
s21.设计用于扩增目的基因的第一引物对和用于扩增载体模板的第二引物对;其中,所述第一引物对包括第一上游引物和第一下游引物,所述第二引物对包括第二上游引物和第二下游引物,第一上游引物、第一下游引物、第二上游引物和第二下游引物的序列如下,其中,下划线部分为相同的15bp的末端重叠序列;
第二上游引物:
5’
第二下游引物:
5’gaattccggggatccacgcggaa3’
第一上游引物:
5’ggatccccggaattcatgttcaacagcagtctggaag3’
第一下游引物:
5’
s22.提供载体与合成目的基因为模板,采用pcr反向扩增技术扩增含有末端重叠序列a和末端重叠序列b的线性化载体,以及采用pcr扩增技术扩增含有末端重叠序列a’和末端重叠序列b’的目的基因;其中,采用pcr反向扩增技术扩增目的基因的反应体系如下:
采用pcr反向扩增技术扩增线性化载体的反应体系如下:
pcr反向扩增的反应条件为:
98℃,10s;
55℃,5sor15s;
72℃,5s/kb,
30-35个循环。
采用dpnⅰ酶消化去除甲基化保护的原始载体模板。
将采用pcr反向扩增技术扩增线性化载体得到的产物进行核算凝胶电泳检测,结果如图5所示,可见本发明实施例方法扩增得到的线性化载体具有很高的纯度;将采用pcr反向扩增技术扩增目的基因得到的产物进行核算凝胶电泳检测,结果如图6所示,可见本发明实施例方法扩增得到的目的基因具有很高的纯度。
s23.采用takara公司的in-fusion酶将所述线性化载体与所述目的基因连接,得到环状克隆载体;具体的,
反应体系如下:
反应条件为:将所述反应体系混匀后,于50℃条件下孵育15min,放置冰上备用。
s24.将所述环状克隆载体导入宿主细胞,进行表达。
挑取平板上的单菌落进行菌落pcr鉴定(引物采用第一上游引物和第一下游引物),结果如图7所示,随机挑取的10个单菌落均为阳性克隆。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!