一种可对肿瘤靶向治疗相关靶点和免疫治疗相关TMB及MSI同时进行检测的体系的制作方法
本发明涉及一种基于高通量测序平台开发的基因检测体系,可同时检测肿瘤相关靶向治疗和免疫治疗相关基因信息。
背景技术:
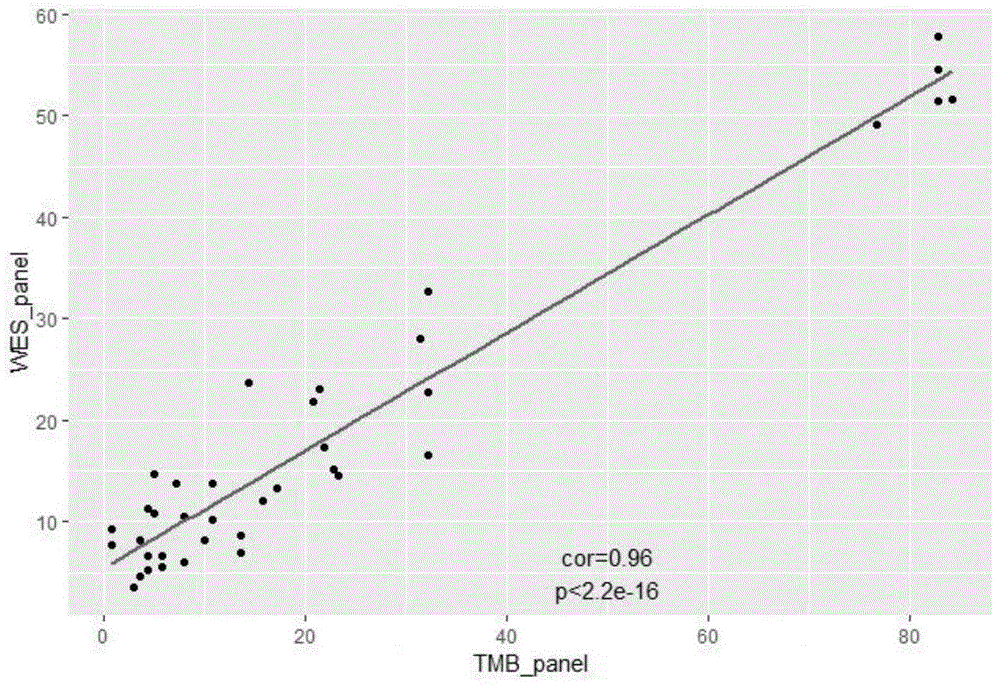
:大量临床研究已经表明,以tki类小分子抑制剂为代表的靶向治疗药物给广大癌症患者带来了更多的获益,相应的伴随诊断产品也成为了临床制定治疗方案前必选的项目之一。靶向治疗虽然可以使病人更多获益,但仍有30%以上的病人因为不符合靶向治疗的标准,无法选择该治疗方案。近年来,免疫检查点抑制剂药物的突破性进展,为癌症患者带来了新的希望,尤其以pd1/pdl1类药物的临床研究最为火热,但不建议在含有驱动基因突变的患者中使用。目前,大多临床专家形成以下共识:一线治疗时首选靶向治疗,若不符合靶向治疗的标准,再考虑免疫治疗。因此,靶向治疗相关驱动基因突变及免疫检查点抑制剂相关分子靶标检测对临床肿瘤治疗均具有重要意义。临床大多以肿瘤手术组织或活检标本为检测目标,一般病理医生可以将组织做成石蜡包埋玻片,通过组织细胞形态,对肿瘤细胞含量及肿瘤类型进行病理诊断,不足之处在于肿瘤组织存在较强异质性,局部组织不能代表整体情况,且很多晚期癌症患者无法获取肿瘤组织,失去了较多治疗选择。研究发现血液中存在肿瘤游离dna,易于获得,且不存在异质性问题,可作为组织样本的最佳替代样本。但其缺点在于,外周血中肿瘤来源游离dna含量较组织样本少,肿瘤突变丰度较低,对检测技术的灵敏度和准确性要求较高。目前临床用于肿瘤靶向治疗的伴随诊断产品多以arms-pcr为主,灵敏度和准确性都较高,缺点是通量相对较低,于是更多的检测产品逐渐转向高通量测序(ngs)平台。免疫治疗疗效与机体免疫状态有较大相关性,临床研究显示pdl1高表达或肿瘤突变负荷(tmb)较高或错误修复系统缺陷的患者疗效较好,因此临床关于免疫检查点抑制剂药物的伴随诊断产品基本围绕pdl1表达、tmb(tumormutationburden,肿瘤突变负荷)检测及msi(microsatalliteinstability,微卫星不稳定)检测展开,三种分子靶标的检测方法一般为:免疫组化、ngs、pcr+sanger。综上所述,目前临床用于肿瘤治疗的分子靶标较多,涉及基因组范围内多个基因、多种突变类型,传统检测方式多样,但均只能检测个别靶标,要做到精准、全面的治疗,需要多种方法、多个技术平台的综合使用,成本高、速度慢、操作复杂。技术实现要素:本发明提供了一种可对肿瘤靶向治疗相关靶点和免疫治疗相关tmb及msi同时进行检测的体系,该体系基于高通量测序技术开发,采用探针捕获的靶向测序方法,结合生物信息分析技术,可同时适用于组织样本类型和血液样本类型。一种可对肿瘤靶向治疗相关靶点和免疫治疗相关tmb及msi同时进行检测的体系,包括:文库制备试剂;所述的文库根据提取的dna类型而定,ctdna样本直接进行建库而得;组织样本进行片段化,使其长度集中在200~500bp左右,再建库而得;所建的文库,两端接头含有6~12bp的随机分子标签;探针:探针为dna探针,长度在30~150bp之间,覆盖的区域包括含egfr、alk在内的靶向治疗药物相关基因靶点和至少200个msi位点;测序系统,能够对文库进行测序;数据分析系统;所述数据分析系统能够分析包括数据质控信息和统计信息、突变位点信息及tmb数值在内的结果。本发明所述的术语“文库”的含义为:两端含有一段特定相同序列的dna片段分子库,包括了全部基因组或部分基因组的序列信息,可以被同一段序列进行扩增或信息读取。本发明所述的术语“建库”的含义为:将一系列dna片段分子两端连上加上特定序列标签的过程。与现有检测产品相比,本发明的主要有益效果有:1、适用范围广:可同时适用于组织样本和液体活检样本。2、检测范围全:同时检测靶向药物相关位点、pd1/pdl1相关免疫治疗分子指标,通过一次性检测,可同时指导或辅助指导靶向治疗和免疫治疗。本发明的直接目的不是得到疾病诊断结果,而是为指定个性化治疗方案提供参考依据。3、节约样本:只需要一份样本,就可同时对多种基因信息进行检测,有效解决了病人样本量不足以同时检测多个项目的问题。4、节省时间:一次检测可以获得多个有效信息,不需要等靶向治疗相关检测结果出来之后再进行免疫治疗相关检测。5、准确性高:文库接头部分设计有分子标签,可对扩增中产生的错误进行校准,结果更加准确可靠。6、灵敏度高:对于组织样本灵敏度可以达到1%,对于血液样本,灵敏度可以达到0.5%,高灵敏度可减少低频突变的漏检,提升阳性检出率,增加患者获益概率。附图说明图1为实施例2中tmb分析结果与wes结果对比。具体实施方式一种可对肿瘤靶向治疗相关靶点和免疫治疗相关tmb及msi同时进行检测的方法,包括以下步骤:1、样本采集:本产品可同时适用于外周血样本和肿瘤组织样本。外周血样本可通过高速离心的方式分离血浆和白细胞,以血浆样本抽提的dna作为检测样本,以白细胞作为对照样本;组织检测样本可以为新鲜手术组织、穿刺组织、ffpe、石蜡包埋块、蜡卷、胸水等,对照样本可以选择白细胞样本、唾液样本、口腔拭子或者癌旁组织样本等可获取个人全部遗传信息的非癌症组织样本,优选白细胞样本,肿瘤组织样本建议进行病理质控,肿瘤细胞含量最好不低于20%。2、dna提取:使用dna提取试剂盒进行dna提取,dna质量应不低于10ng,260/280吸光值在1.8~2.0之间,组织样本主要dna片段分布应不低于200bp。3、文库制备:文库制备一般含4个主要过程(末端修复、加a、加接头、文库扩增),两端接头含有6~12bp的随机分子标签,用于分子校准,接头为illumina、thermofisher、bgiseq等测序平台中的任意一种。ctdna样本可直接进行建库,组织样本需进行片段化,使其长度集中在200~500bp左右,再开始建库步骤。4、杂交捕获:制备好的全基因组文库需先进行探针捕获。探针为dna探针,长度在30~150bp之间,覆盖的区域包括全基因组范围内至少448个基因(详细列表见附录1),含egfr、alk等靶向治疗药物相关基因靶点和至少200个msi位点。确定好基因位置信息后,根据人类基因组参考序列,挑选相应探针序列,探针序列从每个区域的上下游各外延100bp开始挑选,每条探针长度为30~150bp之间,gc含量在20%~80%之间,所有探针呈交叠状态,重叠区域为3bp-100bp,每个碱基覆盖的探针条数不超过3条;探针序列设计好后按照0.5-1.5:0.5-1.5比例进行混合。5、捕获文库扩增:捕获后文库需要再次进行扩增,扩增循环数为8~20个,扩增后文库总量应>10ng。6、上机测序:测序可以为单端测序或双端测序,单条模板测序总读长应不低于2×75bp,组织样本数据量建议为10gp以上,要求不低于5gbp,测序深度在2000×以上;血浆样本测序数据量建议为20gbp以上,要求不低于5gbp,测序深度在2000×以上;若有对照样本,对照样本测序深度建议为2gbp以上,要求不低于0.2gbp。7、数据分析:分析包括数据质控信息和统计信息、突变位点信息及tmb数值。突变位点判定标准如下:对于组织样本,单点覆盖深度应≥100×,与参考序列不一致碱基比例≥5%,若为靶向药物相关突变,与参考序列不一致碱基比例应≥1%;对于血浆样本,单点覆盖深度应≥500×,与参考序列不一致碱基比例≥0.5%。8、结果解读:若检测到热点突变,则记录突变点;若未检测到热点突变,则记录未检测到热点突变,然后进一步计算tmb数值和msi检测。9、tmb数值的计算:首先将检测到的所有位点进行过滤,可使用对照样本信息或群体数据库信息,去除待检样本中含有的胚系突变信息,得到突变集a。从突变集a中,将热点突变位点过滤掉,得到突变集b。再进一步将突变集b中位于编码区以外区域的突变过滤掉,得到突变集c。计算突变集c中点突变、插入缺失突变的个数,除以检测区域大小,即为该样本的tmb数值t。t≥10为tmb-h,t<10为tmb-l。10、msi检测:本发明涉及msi位点共57个(附录2),该算法根据二代高通量测序片段的个数计算微卫星位点对应的重复序列长度覆盖率mean1和标准差sd1、主要重复单元数mean2和标准差sd2,从而构建参考集。使用参考集对待测样本的微卫星位点进行判定,若待测样本微卫星位点平均覆盖度<mean1-2sd1或待测样本微卫星位点主要重复单元平均数>mean2+3sd2,则该位点判定为msi。若待测样本中判定为msi的位点数<总msi位点数的20%,则待测样本为mss;若待测样本中判定为msi的位点数≥总msi位点数的40%,则待测样本为msi-h;介于20%~40%之间的判定为msi-l。实施例1:已知热点突变样本位点检测检测步骤:1、dna打断:取检测合格的ffpe样本dna200ng,使用130ul体积打断管进行打断,打断后取125ul打断产物,分别用100ul磁珠和50ul磁珠进行片段筛选,25ul纯化水进行洗脱。2、文库制备:打断后dna进行定量,以荧光定量法为准,取20ng打断后产物,补水至25ul,加入3.5ul末端修复缓冲液和1.5ul末端修复酶,按照以下程序运行:20℃30min+65℃30min+4℃保存。末端修复产物加入0.3ul接头、15ul连接缓冲液和0.5ul增强子,20℃15min,然后4℃保存。连接产物使用44ul磁珠进行纯化,25ul纯化水进行洗脱。取23ul连接纯化产物,加入25ul扩增反应液、1ulp5引物和1ulp7引物,按照以下程序进行扩增。扩增产物再用40ul磁珠纯化,25ul纯化水进行洗脱。3、文库质控:浓度>30ng/ul,片段在300-500bp之间且无二聚体(170bp)为合格。4、杂交反应:待杂交文库按照所需数据量比例进行混合,总量为1000ng,加入含7ul封闭剂的pcr管中,浓缩蒸干(60℃)。往pcr管中加入杂交液等,95℃5min+47℃16h杂交过夜。试剂取用量(ul)2×捕获缓冲液7.5杂交组分a3probelibrary(探针库)4.5所述的探针库,建立方法如下:确定好基因位置信息后,根据人类基因组参考序列,挑选相应探针序列,探针序列从每个区域的上下游各外延100bp开始挑选,每条探针长度为30~150bp之间,gc含量在20%~80%之间,所有探针呈交叠状态,重叠区域为3bp-100bp,每个碱基覆盖的探针条数不超过3条;探针序列设计好后按照1:1比例进行混合。5、磁珠捕获:取100ul链霉素磁珠于1.5ml离心管内,去上清,加入200洗涤缓冲液洗一次,重复一次,再加入100ul洗涤液,转移至pcr管中,磁力架上弃上清。杂交文库加入到磁珠中混匀,abi2720pcr仪上,48℃45min,15min混匀一次。6、洗涤准备:洗涤液从冰箱中取出后放金属浴预热,待完全澄清后,按表格稀释洗涤液,将②取110ul出来,与①一起放48℃30min。按照洗涤顺序:②→①→①→②→③→④进行洗涤。7、洗涤操作:取预热的100ul②加入到含杂交液和磁珠的pcr管中,小心吹吸10次,转移至1.5ml离心管中,弃上清。加入预热的①200ul,迅速吹打混匀,防止温度下降,48℃5min,磁力架上弃上清,重复一次。后面分别用200ul②→③→④进行洗涤,每次震荡混匀时间从2min开始逐渐缩短30s。8、带磁珠扩增:加入50ul纯化水混匀,加入扩增试剂后进行扩增,程序如下:9、捕获后纯化:产物转移至1.5ml离心管中,30ul+20ul磁珠双筛,25ul纯化水洗脱。10、捕获后文库质控:浓度>10ng/ul,片段在300-500之间为合格。11、上机测序:每个子文库上机数据量之和为捕获后文库总的数据量,测序读长为2×150bp。12、数据质控:q30>80%,比对率>90%,目标区域覆盖度>90%,样本数据量高于预期数据量,满足以上条件为数据合格,可进行后续分析,详见附录一附表3。13、数据分析:使用厦门艾德生物信息分析系统进行分析,突变信息如下,与预期结果一致。实施例2:37例样本进行tmb检测,操作步骤同实施例1,tmb分析结果与wes结果对比,一致性较高。数据质控结果见附录一附表4,tmb数值结果见附录一附表5。实施例3:20例样本进行msi检测,操作步骤同实施例1,msi检测结果与sanger检测的结果对比,一致性较高。数据质控结果见附录一附表6。附录1表1用于检测点突变与插入缺失突变的基因列表表2同时检测点突变、插入缺失及融合突变的基因列表表3测序数据质控信息表1表4测序数据质控信息表2表5tmb数值信息表表6测序数据质控信息表3附录二表2微卫星位点信息当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 阻断UBE2M介导Neddylation修饰在肾细胞癌治疗中的应用的制造方法与工艺
- 无载体共组装肿瘤靶向抗癌纳米药物及其制备方法与应用与流程
- 一种用于判断靶向单克隆抗体治疗肿瘤疗效的预测分子的制造方法与工艺
- 一种靶向CD47的免疫检查点抑制剂药物组合物及其制备方法与流程
- 具有淋巴靶向功能的生物自组装纳米晶注射剂及制备方法与流程
- 用于检测肝癌的基因标志物及其用途的制造方法与工艺
- 特异性shRNA筛选及其靶向Ang‑2基因抑制肺癌细胞的验证方法与流程
- 一种多功能自动化生物细胞提取分离控制系统及采用该系统实现的细胞提取分离方法与流程
- 一种融合蛋白及光敏剂复合物及其制备方法和应用与流程
- 具有可视化和显示光斑边界功能的光动力治疗系统的制造方法与工艺