一种基于改良聚乙二醇沉淀法分离外泌体的方法与流程
本发明属于外泌体分离技术领域,具体涉及一种基于改良聚乙二醇沉淀法分离外泌体的方法。
背景技术:
外泌体是一种活细胞在生理或病理状态下主动分泌到细胞外的膜性囊泡,其携带蛋白,运送rna,其内容物包括蛋白质、短链肽、dna片段、lncrna、磷脂以及mirna。外泌体膜表面除了共有标记物(如cd9、cd63、cd81等)外,亦表达多种特异性标记物(如gpc1、gpc3、psma、tmem256、epcam等),这些特异性外泌体高度反映了宿主细胞类型和状态。研究显示,分离检测特异性外泌体对疾病诊断、治疗监控与预后判断具有重要意义,尤其在恶性肿瘤诊断方面具有很高诊断特异性和诊断灵敏度。
基于聚乙二醇的外泌体沉淀法是继超速离心之后应用最广的方法,占已发表论文的25%以上。聚乙二醇可与疏水性蛋白和脂质分子结合共沉淀,从而使溶解度较小的分子或外泌体在聚乙二醇溶液中溶解度降低并析出。该方法通常通过低速离心进行外泌体沉降,以减少样品和聚乙二醇溶液的混合。当前,基于聚乙二醇的外泌体沉淀法的技术,普遍存在难以克服的技术难题:纯度和回收率低,杂蛋白较多,颗粒大小不均一,生物聚合物难去除等。
因此,有必要提供改进的技术方案以克服现有技术中存在的技术问题。
技术实现要素:
为解决现有技术存在的问题,本发明提供一种本发明通过改良基于聚乙二醇沉淀法的外泌体分离方法,减少了现有技术分离外泌体时存在的非外泌体蛋白和其他杂质的共沉淀污染,外泌体的纯度和产量大幅地提高。
本发明第一方面提供一种基于改良聚乙二醇沉淀法分离外泌体的方法,所述的外泌体分离方法包括:
(1)将液体样本以10,000~30,000g速度于37℃离心5~15分钟,收集沉淀和上清s1;
(2)将步骤(1)里的沉淀重悬于分离液,混匀,加入dtt;
(3)将步骤(2)得到的液体,37℃孵育5~15分钟,期间混匀3-5次;
(4)在步骤(3)得到的液体中,加入分离液,混匀,10,000~30,000g于37°c离心5~15分钟,收集上清s2;
(5)将步骤(1)所得的上清s1与步骤(3)所得的上清s2进行混合,再加入包含peg8000的沉淀液,混匀后0~10℃放置1-12小时(可过夜冷藏);
(6)将步骤(5)所得的成分,在10,000~20,000g室温离心20~30分钟,弃上清,然后再以1,000~2,000g离心2~5分钟,去除所有液体,得到外泌体。
通过上述技术方案,可减少外泌体提取过程中非外泌体蛋白和其他杂质的共沉淀污染,使外泌体的纯度和产量大幅地提高。
优选地,在如前所述的基于改良聚乙二醇沉淀法分离外泌体的方法中,所述的基于改良聚乙二醇沉淀法分离外泌体的方法,其特征在于,所述的dtt的添加量为终浓度150~250mg/ml。通过该技术方案,可使外泌体得到充分分散,使外泌体与非外泌体蛋白和其他杂质分离,以便于收集步骤(1)里沉淀中的外泌体。
优选地,在如前所述的基于改良聚乙二醇沉淀法分离外泌体的方法中,所述的分离液是通过下述方法制备而得:将200~500mm蔗糖,3~20mm三乙醇胺进行混合,然后调节ph至7.6。通过该技术方案,可使步骤(1)里沉淀中的外泌体分散在分离液中便于收集。
优选地,在如前所述的基于改良聚乙二醇沉淀法分离外泌体的方法中,所述的包含peg8000的沉淀液是通过下述方法制备而得:将乙酸钠按1:3~1:2的比例(重量份)溶入peg8000中得到弱碱性peg液。通过该技术方案制备的优化溶液,可中和外泌体表面的阴性负离子,促进外泌体聚集沉降,收集得到更多的外泌体,分离效率远超单一乙酸钠溶液或目前市面上常用的peg6000。
优选地,在如前所述的基于改良聚乙二醇沉淀法分离外泌体的方法中,所述的包含peg8000的沉淀液的添加体积,需使peg8000终浓度为8-10%(mg/ml)。通过该技术方案,可使外泌体得到充分聚集沉降。
优选地,在如前所述的基于改良聚乙二醇沉淀法分离外泌体的方法中,步骤(2)所述的分离液和步骤(4)所述的分离液的体积比值为1~3:1~5。通过该技术方案,可使步骤(1)里沉淀中的外泌体充分分散于上清s2中。
优选地,在如前所述的基于改良聚乙二醇沉淀法分离外泌体的方法中,步骤(1)所述的液体样本和步骤(2)所述的分离液的体积比值为1~50:1~3。通过该技术方案,可使步骤(1)里沉淀中的外泌体充分分散于上清s2中。
本发明第二方面提供一种前述的基于改良聚乙二醇沉淀法分离外泌体的方法得到的外泌体。
本发明第三方面提供一种根据前述方法得到的外泌体在生物或医学领域中的应用。
本发明创造的有益效果:本发明通过改良基于聚乙二醇沉淀法的外泌体分离方法,减少了现有技术分离外泌体时存在的非外泌体蛋白和其他杂质的共沉淀污染,外泌体的纯度和产量大幅地提高。
附图说明
为了更清楚地说明本发明的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
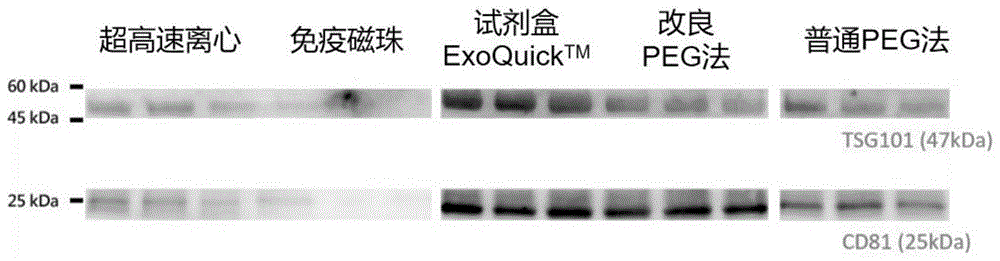
图1为western-blot实验的结果;
图2为透射扫描电子显微镜(tem)检测外泌体形态的结果;
图3为nta检测比较改良peg法,普通peg法和exoquicktm收集到的颗粒数量分布;
图4为nta检测比较超速离心法和免疫磁珠法收集到的颗粒数量分布;
图5为外泌体纯度比较,其中,1为超速离心法,2为免疫磁珠法,3为普通peg法,4为exoquicktm试剂盒,5为改良peg法。
具体实施方式
下列实施例中未注明具体条件的实验方法,通常按照国家标准测定。若没有相应的国家标准,则按照通用的国际标准、常规条件、或按照制造厂商所建议的条件进行。
可对本发明提到的特征或实施例提到的特征进行组合。本说明书所揭示的所有特征可与任何组合物形式并用,说明书中所揭示的各个特征,可以任何可提供相同、均等或相似目的的替代性特征取代。因此除有特别说明,所揭示的特征仅为均等或相似特征的一般性例子。
在本发明中,如果没有特别的说明,本文所提到的所有实施方式以及优选实施方式可以相互组合形成新的技术方案。
在本发明中,如果没有特别的说明,本文所提到的所有技术特征以及优选特征可以相互组合形成新的技术方案。
在本发明中,如果没有特别的说明,本文所提到的所有实施方式以及优选实施方式可以相互组合形成新的技术方案。
在本发明中,如果没有特别的说明,本文所提到的所有技术特征以及优选特征可以相互组合形成新的技术方案。
为使本发明实现的技术手段、创作特征、达成目的与功效易于明白了解,下面结合具体实施方式,进一步阐述本发明,但本发明包括但不限于这些实施例。
实施例1.一种基于改良聚乙二醇沉淀法分离外泌体的方法
本实施例主要描述了一种基于改良聚乙二醇沉淀法分离外泌体的方法,包括以下步骤:
步骤一、主要溶液的制备:
(a)分离液:250mm蔗糖,10mm三乙醇胺,调节ph至7.6;
(b)沉淀液:将乙酸钠按1:3比例(重量份)溶入peg8000中得到弱碱性peg液。
步骤二、外泌体的分离操作:
(1)无菌管收集样本(血浆)1ml,以17,000g速度于37°c离心10分钟,收集沉淀和上清s1;
(2)将步骤(1)里的沉淀重悬于1ml分离液,混匀,加入适量dtt(终浓度200mg/ml);
(3)将步骤(2)得到的液体,37°c孵育10分钟,期间混匀3-5次;
(4)在步骤(3)得到的液体中,加入2ml分离液,混匀,17,000g于37°c离心10分钟,收集上清s2;
(5)将上清s1与s2混合后,加入沉淀液使peg8000终浓度9%(mg/ml),混匀后4°c放置1小时;
(6)15,000g室温离心30分钟,可见白色外泌体沉淀,弃上清后,1,500g离心5分钟,小心去除所有液体,即可得到需要的外泌体;
根据后续检测的需要,可加入适量体积的不同检测溶液重悬外泌体,进行使用。
实施例2.一种基于改良聚乙二醇沉淀法分离外泌体的方法
本实施例主要描述了一种基于改良聚乙二醇沉淀法分离外泌体的方法,包括以下步骤:
步骤一、主要溶液的制备:
(a)分离液:200mm蔗糖,20mm三乙醇胺,调节ph至7.6;
(b)沉淀液:将乙酸钠按1:2(重量份)比例溶入peg8000中得到弱碱性peg液。
步骤二、外泌体的分离操作:
(1)无菌管收集样本(血浆)10ml,以30,000g速度于37°c离心5分钟,收集沉淀和上清s1;
(2)将步骤(1)里的沉淀重悬于3ml分离液,混匀,加入适量dtt(终浓度250mg/ml);
(3)将步骤(2)得到的液体,37°c孵育5分钟,期间混匀3-5次;
(4)在步骤(3)得到的液体中,加入5ml分离液,混匀,10,000g于37°c离心15分钟,收集上清s2;
(5)将上清s1与s2混合后,加入沉淀液使peg8000终浓度10%(mg/ml),混匀后0°c放置12小时(可过夜冷藏);
(6)20,000g室温离心20分钟,可见白色外泌体沉淀,弃上清后,2,000g离心2分钟,小心去除所有液体,即可得到需要的外泌体;
根据后续检测的需要,可加入适量体积的不同检测溶液重悬外泌体,进行使用。
实施例3.一种基于改良聚乙二醇沉淀法分离外泌体的方法
本实施例主要描述了一种基于改良聚乙二醇沉淀法分离外泌体的方法,包括以下步骤:
步骤一、主要溶液的制备:
(a)分离液:500mm蔗糖,3mm三乙醇胺,调节ph至7.6;
(b)沉淀液:将乙酸钠按1:2.5比例(重量份)溶入peg8000中得到弱碱性peg液。
步骤二、外泌体的分离操作:
(1)无菌管收集样本(血浆)6ml,以10,000g速度于37°c离心15分钟,收集沉淀和上清s1;
(2)将步骤(1)里的沉淀重悬于1.8ml分离液,混匀,加入适量dtt(终浓度150mg/ml);
(3)将步骤(2)得到的液体,37°c孵育15分钟,期间混匀3-5次;
(4)在步骤(3)得到的液体中,加入1ml分离液,混匀,30,000g于37°c离心5分钟,收集上清s2;
(5)将上清s1与s2混合后,加入沉淀液使peg8000终浓度8%(mg/ml),混匀后10°c放置2小时;
(6)10,000g室温离心30分钟,可见白色外泌体沉淀,弃上清后,1,000g离心5分钟,小心去除所有液体,即可得到需要的外泌体;
根据后续检测的需要,可加入适量体积的不同检测溶液重悬外泌体,进行使用。
实施例4.一种基于改良聚乙二醇沉淀法分离外泌体的方法
本实施例主要描述了一种基于改良聚乙二醇沉淀法分离外泌体的方法,与实施例1的不同之处,步骤二中的样本为尿液。
实施例5.一种基于改良聚乙二醇沉淀法分离外泌体的方法
本实施例主要描述了一种基于改良聚乙二醇沉淀法分离外泌体的方法,与实施例2的不同之处,步骤二中的样本为尿液。
实施例6.一种基于改良聚乙二醇沉淀法分离外泌体的方法
本实施例主要描述了一种基于改良聚乙二醇沉淀法分离外泌体的方法,与实施例3的不同之处,步骤二中的样本为尿液。
实施例7.一种基于改良聚乙二醇沉淀法分离外泌体的方法
本实施例主要描述了一种基于改良聚乙二醇沉淀法分离外泌体的方法,与实施例1的不同之处,步骤二中的样本为唾液。
实施例8.一种基于改良聚乙二醇沉淀法分离外泌体的方法
本实施例主要描述了一种基于改良聚乙二醇沉淀法分离外泌体的方法,与实施例2的不同之处,步骤二中的样本为唾液。
实施例9.一种基于改良聚乙二醇沉淀法分离外泌体的方法
本实施例主要描述了一种基于改良聚乙二醇沉淀法分离外泌体的方法,与实施例3的不同之处,步骤二中的样本为唾液。
实施例10.一种基于改良聚乙二醇沉淀法分离外泌体的方法
本实施例主要描述了一种基于改良聚乙二醇沉淀法分离外泌体的方法,与实施例1的不同之处,步骤二中的样本为细胞培养上清。
实施例11.一种基于改良聚乙二醇沉淀法分离外泌体的方法
本实施例主要描述了一种基于改良聚乙二醇沉淀法分离外泌体的方法,与实施例2的不同之处,步骤二中的样本为细胞培养上清。
实施例12.一种基于改良聚乙二醇沉淀法分离外泌体的方法
本实施例主要描述了一种基于改良聚乙二醇沉淀法分离外泌体的方法,与实施例3的不同之处,步骤二中的样本为细胞培养上清。
实施例13.和现有外泌体分离方法相比的外泌体分离检测
外泌体提取的常见方法包括超高速离心,免疫磁珠分离,普通peg沉淀法,以及试剂盒exoquicktm(systembiosciences)。除了超高速离心,免疫磁珠分离法,其余方法都是以peg沉淀法为技术核心。
采集健康人血清3ml(相同样本采集5份),分别采用实施例1所述的方法(即图1所示的改良peg法)、超高速离心,免疫磁珠分离,普通peg沉淀法,以及试剂盒exoquicktm(systembiosciences)所述的方法进行外泌体的分离,然后进行western-blot检测(western-blot检测采用该文献所述方法zhangjing,lushaohua,zhouyeetal.motilehepatocellularcarcinomacellspreferentiallysecretsugarmetabolismregulatoryproteinsviaexosomes.[j].proteomics,2017,17),得到如图1所示的实验数据。实验结果表明,采用实施例1所述的方法(即图1所示的改良peg法)成功分离出外泌体。
在本实施例中,超高速离心分离外泌体采用文献所述(jeppesendennisk,hvammichaell,primdahl-bengtsonbjarkeetal.comparativeanalysisofdiscreteexosomefractionsobtainedbydifferentialcentrifugation.[j].jextracellvesicles,2014,3:25011.)方法进行,免疫磁珠分离外泌体采用专利所述([发明公布]一种使用免疫磁珠分离血清中外泌体的方法.申请公布号:cn107893051a)方法进行,普通peg沉淀法分离外泌体采用文献所述(wengyejing,suizhigang,shanyichuetal.effectiveisolationofexosomeswithpolyethyleneglycolfromcellculturesupernatantforin-depthproteomeprofiling.[j].analyst,2016,141:4640-6.)方法进行,试剂盒exoquicktm(systembiosciences)分离外泌体采用文献所述(chenzhipeng,yanglijuan,cuiyizhietal.cytoskeleton-centricproteintransportationbyexosomestransformstumor-favorablemacrophages.[j].oncotarget,2016,7:67387-67402.)方法进行。
同样采用实施例2~12的方法分离外泌体,得到与图1类似的实验结果。
实施例14.和现有外泌体分离方法得到外泌体的形态和数目的对比实验
采集健康人血清3ml(相同样本采集5份),分别采用实施例1所述的方法(即图2所示的改良peg法)、超高速离心,免疫磁珠分离,普通peg沉淀法,以及试剂盒exoquicktm(systembiosciences)所述的方法进行外泌体的分离,然后进行透射扫描电子显微镜(tem)检测外泌体形态,得到如图2所示的实验数据,图中箭头所示为外泌体。实验结果表明,与其他提取方法相比,实施例1所述的方法(即图2所示的改良peg法)提取的外泌体背景更干净,数量更多。
同样采用实施例2~12的方法分离外泌体,得到与图2类似的实验结果。
实施例15.和现有外泌体分离方法得到外泌体的nta检测比较实验
采集健康人血清3ml(相同样本采集5份),分别采用实施例1所述的方法(即图3所示的改良peg法)、超高速离心,免疫磁珠分离,普通peg沉淀法,以及试剂盒exoquicktm(systembiosciences)所述的方法进行外泌体的分离,然后进行nanoparticletrackinganalysis(nta)分析(具体技术参数参照zhangjing,lushaohua,zhouyeetal.motilehepatocellularcarcinomacellspreferentiallysecretsugarmetabolismregulatoryproteinsviaexosomes.[j].proteomics,2017,17)比较,得到如图3和图4所示的实验数据。实验结果表明,实施例1所述的方法(即图3所示的改良peg法),普通peg法和exoquicktm分离的外泌体进行nta分析后,主峰均落在100-150nm区间内,且改良peg法收集颗粒在100nm附近的比例较高(如图3所示),另外三者以peg沉淀法收集的外泌体数量远高于超速离心和免疫磁珠法(如图4所示)。
同样采用实施例2~12的方法分离外泌体,得到与图3和图4类似的实验结果。
实施例16.和现有外泌体分离方法得到外泌体的提取纯度对比
采集健康人血清3ml(相同样本采集5份),分别采用实施例1所述的方法(即图5所示的5)、超高速离心,免疫磁珠分离,普通peg沉淀法,以及试剂盒exoquicktm(systembiosciences)所述的方法进行外泌体的分离,然后进行外泌体纯度的分析比较实验,得到如图5(其中,1为超速离心法,2为免疫磁珠法,3为普通peg法,4为exoquicktm试剂盒,5为改良peg法)所示的实验数据,外泌体的提取纯度,是以外泌体颗粒的总数量与总蛋白量的比例來定义外泌体提取纯度。其中,外泌体颗粒的总数量由nta的结果计算所得,总蛋白以bio-rad的dcproteinassay测量。实验结果表明,采用采用实施例1所述的方法(即图5所示的改良peg法)提取到的外泌体数量相比提取物总蛋白量的比例最高,即纯度最高。
同样采用实施例2~12的方法分离外泌体,得到与图5类似的实验结果。
在本发明中,通过改良基于聚乙二醇沉淀法的外泌体提取方法,减少了现有技术分离外泌体时存在的非外泌体蛋白和其他杂质的共沉淀污染,外泌体的纯度和产量大幅地提高。
以上显示和描述了本发明的基本原理和主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
- 还没有人留言评论。精彩留言会获得点赞!