检测器联用法测定瑞格列奈二甲双胍片中瑞格列奈的杂质的制作方法
本发明属于药物分析领域,具体涉及通过高效液相色谱法分离测定复方瑞格列奈二甲双胍片中瑞格列奈杂质的方法。
背景技术:
瑞格列奈二甲双胍片为瑞格列奈及盐酸二甲双胍复合制剂,由诺和诺德公司(novonordisk)研制开发,于2008年6月23日获fda批准,在美国上市,商品名为
瑞格列奈化学名为s(+)-2-乙氧基-4-{2-[(3-甲基-1-(2-(1-哌啶基)苯基)丁基)氨基]-2-氧代乙基}苯甲酸,分子式为c27h16n2o4,化学结构式r如下。
瑞格列奈化学结构式
瑞格列奈在合成过程中的起始原料、中间体、终产物类似物及降解产物等均可能成为杂质,该产品为糖尿病患者长期服用常规药物,若产品中的杂质含量较高,容易对患者产生长期毒性,因此需对产品中的杂质进行严格控制。
瑞格列奈原料已被收载于世界主要现行国家药典标准中(欧洲药典、美国药典及中国药典),所控制的该物质杂质的结构和化学式信息见表1。
表1瑞格列奈的杂质结构和化学式
杂质1与杂质3为瑞格列奈酰胺键断裂后的降解产物,杂质2、杂质4为合成副产物,杂质5为原料带入杂质,此5种杂质均会影响该物质制备成制剂后的产品质量,应进行全面控制。各国药典对瑞格列奈杂质控制情况如下:中国药典2015年版无已知杂质控制,欧洲药典9.2版标准中对5种已知杂质进行控制(其中杂质e为光学异构体,有单独的测定方法,未控制美国药典标准中的杂质c),美国药典42版控制3种已知杂质(其中有2种已知杂质与欧洲药典相同)。因此,各国药典均不能全面控制表1内5种杂质。
另外,复方瑞格列奈二甲双胍片目前没有可供参考的药典标准方法,且由于复方制剂中含有较大量的盐酸二甲双胍成分(盐酸二甲双胍与瑞格列奈的质量比为500:1),在二极管阵列检测器条件下对瑞格列奈及其杂质的的检测存在严重干扰,各药典中瑞格列奈标准方法(均采用二极管阵列检测器)即现有技术并不适用于该复方片中的瑞格列奈的杂质控制。
专利申请cn101929987b仅为瑞格列奈原料合成过程中的一种中间体的检测,该中间体与ep杂质c相同。ep杂质c属于降解杂质,应在成品的存放过程中进行控制。《hplc法测定瑞格列奈二甲双胍片片中瑞格列奈的有关物质》(沈阳大学学报,2016)采用欧洲药典7.0版本方法中的色谱条件,仅将检测器改为荧光检测器,控制了欧洲药典中的三种杂质(a、b、d)。《加校正因子法的主成分自身对照发测定复方制剂中瑞格列奈有关物质》(药物分析杂志,2015),采用色谱条件与ep7.0一致,通过优化配样溶剂减少盐酸二甲双胍干扰,并提高待测样品的测定浓度方法来提高灵敏度。此法虽使用乙腈作为溶剂溶剂,但盐酸二甲双胍在乙腈中仍有一定的溶解度,不能完全排除其在色谱中的响应。由文中图谱可见,阴性样品溶液与文中所述的杂质a(即本发明中杂质1)出峰位置非常接近,使方法专属性下降;另外,由于待测样品的片重较大,若想配制到文中的待测样品浓度,则需用很少量的溶液溶解大量固体粉末,这将影响该法的准确度与精密度。
本发明采用两种检测器联用,对复方瑞格列奈二甲双胍片中瑞格列奈的5种杂质进行全面控制。与上述专利及文献中方法相比,本法优势是:(1)能排除复方制剂中盐酸二甲双胍对杂质1检出的干扰(盐酸二甲双胍在荧光检测其中无响应);(2)通过采用特定色谱柱,实现了杂质5与瑞格列奈的分离,进行一同控制,增加样品的安全性(3)荧光检测器对瑞格列奈及其杂质1、2、4、5具有较高的灵敏度,因此可将待测样品溶液中待测样品浓度配制在较低水平,增强样品制备的可操作性,增强了测定方法的准确度与精密度。(4)相同测定浓度下,杂质3在荧光检测器中响应值较低,而此杂质在二极管阵列检测器中响应值相对较高,采用串联二极管阵列检测器方法,在二极管阵列检测器中检测并控制杂质3。
综上所述,本发明中的方法突出了两种检测器联用及色谱柱优化的创新性,在较简便样品配制过程、较低的检测浓度基础上,能够较全面控制复方制剂中较低规格组分中的杂质水平,增强了样品的安全性。该方法科学简便、可操作性及专属性较强,具有较高的灵敏度、准确度及精密度
技术实现要素:
本发明要解决的技术问题是提供一种通过串联两种检测器的高效液相色谱法分离测定复方瑞格列奈二甲双胍片中瑞格列奈杂质的方法,以克服现有技术的不足,可对复方瑞格列奈二甲双胍片中的瑞格列奈的进行相关杂质的分离测定。
本发明是通过以下技术手段实现的。
检测器联用法测定瑞格列奈二甲双胍片中瑞格列奈的杂质,采用以下方式进行:
采用高效液相色谱法,色谱条件包括:以辛烷基硅烷键合硅胶为填充剂;以磷酸二氢钾缓冲溶液与乙腈为流动相,采用梯度洗脱分离;检测器为二极管阵列与荧光检测器串联,二极管阵列检测器检测波长为210~310nm,荧光检测器的激发波长200~300m、发射波长300~400nm;流速0.5~2.0ml/min,进样体积10~100μl,柱温为20~50℃。
系统适用性溶液配制:瑞格列奈及各杂质混合溶液,采用有机试剂与水的混合溶液配制,其中瑞格列奈浓度为1~100μg/ml,杂质对照品浓度分别为0.02~2μg/ml。
杂质对照品溶液:各杂质对照品溶液均采用有机试剂与水的混合溶液配制,浓度均为0.02~2μg/ml。
样品溶液配制:样品溶液用有机试剂与水的混合溶液配制,浓度为含瑞格列奈1~100μg/ml。
测定:将上述溶液分别注入高效液相色谱仪,记录色谱图。
所述方法中,流动相中磷酸二氢钾缓冲溶液质量分数0.1%~1%,ph值2.0~8.0;磷酸二氢钾缓冲溶液与乙腈初始体积比为90:10~70:30,最终流动相比值为10:90~30:70。
所述方法中,检测波长优选为,二极管阵列检测器检测波长为240nm,荧光检测器的激发波长为244nm,发射波长为348nm。
所述方法中,柱温为40℃。
所述方法中,流速优选为1.0ml/min。
所述方法中,有机溶剂与水的混合溶液中所述的有机溶剂为乙醇,乙醇与水的体积比1:1。
所述方法中,系统适用性溶液含瑞格列奈10μg/ml、杂质对照品1~5各1.0μg/ml;各杂质对照品溶液分别含杂质1~5对照品1.0μg/ml;样品溶液含瑞格列奈10μg/ml。
所述方法中,瑞格列奈二甲双胍片中瑞格列奈的杂质1~5见表1。
所述方法中,用荧光检测器检测杂质1、2、4、5,用二极管阵列检测器检测杂质3。
本发明的有益效果:建立了两种检测器串联使用检测的方法,可同时控制复方瑞格列奈二甲双胍片中5种瑞格列奈的杂质含量(包括欧洲药典瑞格列奈原料标准中要求控制的4种杂质及美国药典瑞格列奈原料标准中1种不相同杂质)。本法可实现瑞格列奈及二甲双胍与瑞格列奈各杂质的完全分离,二甲双胍、瑞格列奈与相邻杂质及各杂质峰之间的分离度均大于1.5,。本法条件下,各杂质峰的浓度与峰面积成良好线性关系,且各杂质在对应的检测器中的灵敏度较高,瑞格列奈、杂质1、杂质2、杂质3、杂质4、杂质5检测限分别为0.06ng、0.07ng、0.05ng、0.2ng、0.1ng、0.06ng。本发明的方法可准确对复方瑞格列奈二甲双胍片中瑞格列奈的杂质进行定量分析,从而保证了复方瑞格列奈二甲双胍片的质量可控性。
附图说明
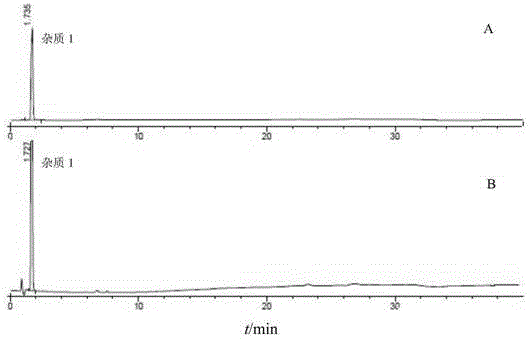
图1实施例1瑞格列奈杂质1图谱。
图2实施例1瑞格列奈杂质2图谱。
图3实施例1瑞格列奈杂质3图谱。
图4实施例1瑞格列奈杂质4图谱。
图5实施例1瑞格列奈杂质5图谱。
图6实施例1系统适用性溶液图谱。
图7实施例1阴性样品溶液图谱。
图8实施例1供试品溶液图谱。
其中:a均为荧光检测器图谱,b均为二极管阵列检测器图谱。
具体实施方式
以下实施例对本发明内容做进一步说明,并不限定本发明。
以下实例所用的瑞格列奈及其杂质对照品1、2、3、4均来自中国食品药品检定研究院,杂质5购自北京谱析科技有限公司,瑞格列奈二甲双胍片为自制(批号201410701),磷酸二氢钾为分析纯,乙腈及乙醇为色谱纯。
实施例1
仪器:agilent1260型高效液相色谱仪(g1329b自动进样器,g1316a恒温柱温箱,g1311c四元泵,g4212b二极管阵列检测器,g1321b荧光检测器)。
色谱柱:agelavenusilasbc18色谱柱(4.6mm×250mm,5μm)。
流动相:以质量分数0.4%磷酸二氢钾缓冲溶液(用磷酸调节ph值3.2)为流动相a,乙腈为流动相b,采用梯度洗脱分离。按照表2进行梯度洗脱。
表2梯度洗脱表(体积比)/%
检测器:二极管阵列及荧光检测器串联,检测波长分别为240nm及激发波长244nm,发射波长348nm。
流速:1.0ml/min,进样体积:50μl,柱温:40℃。
样品溶液制备稀释液:乙醇-水(体积比1:1)。
杂质定位溶液:取杂质1、2、3、4、5对照品各适量,分别用稀释液溶解并稀释制成每1ml中含杂质1.0μg的溶液,摇匀,即得。
系统适用性溶液:取瑞格列奈及杂质1、2、3、4、5对照品各适量,精密称定,用稀释液溶解并稀释制成每1ml中含瑞格列奈10μg及各杂质均1.0μg的混合溶液,摇匀,即得。
供试品溶液的配制:取瑞格列奈二甲双胍片10片,研细成粉,取片粉适量,精密称定,用稀释液溶解并稀释制成每1ml中含瑞格列奈10μg的溶液,摇匀,过滤,取续滤液即得。
阴性样品溶液配制:取盐酸二甲双胍及各辅料以处方比例混合的混粉适量,精密称定,用稀释液溶解并稀释制成每1ml中含盐酸二甲双胍5mg的溶液,摇匀,过滤,取续滤液即得。
测定:取杂质定位溶液及系统适用性溶液分别注入液相色谱仪,记录色谱图,根据杂质定位溶液各杂质峰的出峰时间(见图1~图5)对系统适用性溶液中的杂质进行定位。系统适用性色谱图谱中,荧光检测器中杂质1、杂质2、瑞格列奈、杂质5、杂质4的出峰时间依次为2.156、5.485、17.665、18.466、24.699min(杂质3在荧光检测器中响应较低),相邻峰之间分离度依次为10.289、35.921、2.513、19.438;二极管阵列检测器中杂质1、杂质2、杂质3、瑞格列奈、杂质5、杂质4的出峰时间依次为2.148、5.473、9.724、17.646、18.448、24.680min,相邻峰之间分离度依次为10.801、15.416、30.622、2.677、20.565,均符合要求(见图6)。取阴性样品溶液及供试品溶液分别注入液相色谱仪,阴性样品溶液在主峰及杂质峰位置均无干扰(见图7),供试品溶液中均未有杂质峰检出(见图8)。
实施例2专属性试验
本发明对复方瑞格列奈二甲双胍片进行了强制破坏降解试验,用强光照射、高温、酸、碱水解及氧化的方法进行破坏,以研究降解杂质与主峰的分离度,并在二极管阵列检测器中验证主峰的峰纯度,用以证明方法的专属性。取复方瑞格列奈二甲双胍片20片,研细成粉,分别称取片粉配制如下溶液。
a.样品溶液:称取片粉适量(约相当于0.5mg瑞格列奈),置50ml量瓶中,加稀释液使瑞格列奈溶解并至刻度,摇匀,滤过,取续滤液作为样品溶液。
b.酸破坏样品溶液:称取片粉适量(含瑞格列奈约1mg),置100ml量瓶中,加入4mol/l盐酸溶液2ml,密封,室温放置30min,用4mol/l氢氧化钠溶液调节ph值至中性,用稀释液稀释至刻度,摇匀,滤过,取续滤液作为酸破坏样品溶液。
c.碱破坏样品溶液:称取片粉适量(含瑞格列奈约1mg),置100ml量瓶中,加入4mol/l氢氧化钠溶液2ml,密封,室温放置30min,用4mol/l盐酸溶液调节ph值至中性,用稀释液稀释至刻度,摇匀,滤过,取续滤液作为碱破坏样品溶液。
d.氧化破坏样品溶液:称取片粉适量(含瑞格列奈约1mg),置100ml量瓶中,加入6%过氧化氢溶液5ml,室温放置30min,置80℃水浴放置10min,取出放至室温,用稀释液稀释至刻度,摇匀,滤过,取续滤液作为氧化破坏样品溶液。
e.高温破坏样品溶液:称取片粉适量(含瑞格列奈约1mg),置100ml量瓶中,加稀释液适量超声2min使溶解,密封,置60℃下放置60h,再置80℃水浴中放置3h,取出,放冷至室温,用稀释液稀释至刻度,摇匀,滤过,取续滤液作为高温破坏样品溶液。
f.强光照射破坏样品溶液:称取片粉适量(含瑞格列奈约1mg),置100ml量瓶中,加稀释液适量使溶解,置4500lx强光下放置72h,取出,放冷至室温,用稀释液稀释至刻度,摇匀,滤过,取续滤液作为强光照射破坏样品溶液。
精密量取上述各溶液50μl注入液相色谱仪,用本方法色谱条件进行分析,结果见表3。
表3破坏试验结果
结果显示,本品在高温及强光照射条件下较为稳定,在两种检测器中均未有降解峰被检出,在氧化和酸破坏样品溶液中检测出较多的杂质;在本色谱条件下,样品经过强力破坏后,主峰纯度均在990以上,各破坏样品溶液物料平衡,主峰与前后杂质峰分离度均符合要求。
实施例3检测限试验
取瑞格列奈及其杂质1、2、3、4、5各适量,精密称定,用稀释液溶解并稀释为一系列浓度的溶液,进样测定,取信噪比≥3的浓度点为检测限,结果为:
瑞格列奈、杂质1、杂质2、杂质3、杂质4、杂质5检测限分别为0.06ng、0.07ng、0.05ng、0.2ng、0.1ng、0.06ng,各杂质检测限均在主成分0.05%浓度以下,满足杂质检查灵敏度要求。
以上所描述的实施例是本发明一部分实施例,而不是全部的实施例。本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!